
- •Технология подготовки н. На промыслах.
- •Вакуумные установки (вт).
- •6) Газофракционирование. Может быть производство гелия и производство элементарной серы.
- •Основные параметры процесса.
- •1) Металлы 8 группы: Ni, Co, Pt, Pd, Fe. 2)Окислы и сульфиды: Mo, w, Cr, MoS3
- •2).Сульфатирование спиртов хлорсульфоновой к-той. Нужно своевременно отводить тепло р-ции ,удалять побочно образующийся hCl, т.К реакционная масса быстро загустевает и hCl трудно испаряется.
- •3) Как растворители; 4) в бумажной, текстильной и кожевенной промышленности; 5) для производства пластификаторов.
3) Как растворители; 4) в бумажной, текстильной и кожевенной промышленности; 5) для производства пластификаторов.
Катализаторы окисления парафинов до кислот. Окисление в карбоновые кислоты идет с деструкцией, возможны два варианта окисления низших парафинов в уксусную кислоту и окисления высших парафинов в СЖК. Окисление низших парафинов в уксусную кислоту. Рассмотрим жидкофазное окисление н-бутана, к-рое протекает с деструкцией:
C4H10 + O2 → 2CH3COOH ;
C4H10 + O2 → CH3COC2H5 +H2O
C4H10 + O2 → CH3OCOC2H5 +H2O
Данный процесс проходит в жидкой фазе в мягких условиях в растворе уксусной кислоты Т=140-170ОС Р=5,1 МПа. Для окисления готовят смесь: свежий бутан, возвратный бутан и воздух в соотношении 1: (1,5-2): 12, содержание рециркулята варьируется.
Окисление твердого парафина с СЖК: Сырьем для получения СЖК является нефтяной парафин, выделенный путем депарафинизации из масляных фракций. В зависимости от количества углеродных атомов, нефтяной парафин может подразделяться на твердый (С17-С42), средний (С18-С33) и жидкий (С10-С18). Если использовать твердый парафин, то получится большее число малоценных кислот с числом углеродных атомов более 20. Если использовать жидкие, то получится большое кол-во водорастворимых кислот, до С5 просто теряются с промывными водами. Лучше использовать средний парафин с добавкой 25% жидких. Большое требование предъявляется к содержанию серы и ароматики, которые является ингибиторами. Содержание i-парафинов также нежелательно т.к. они подвергаясь деструкции дают водорастворимые низкомолекулярные кислоты. Наиболее ценными из получаемых кислот являются фракции С5-С20, из которых С5-С9 используются для получения пластификаторов, С10-С16 - для туалетного мыла, С17-С20 - хозяйственного мыла. В результате окисления нефтяного парафина получается смесь различных кислородсодержащих продуктов, которые претерпевают различные превращения (глубокое окисление и деструкция). Самые устойчивые это карбоновые кислоты, которые накапливаются в реакционной массе.
Основные закономерности и параметры процесса
1. Влияние температуры. Окисление парафина уже возможно при 100°С, но оно протекает очень медленно. Скорость окисления увеличивается с повышением Т 125-130°С но с исп-м кат.
2. Влияние давления. Скорость окисления возрастает с повышением давления до 0,2 МПа;.
3. Влияние кат-ра. В качестве кат-ра используются Na-Mn или K-Mn, компонентное соотношение 1:1 (Na:Mn; K:Mn). В качестве натриевого компонента используются соли жирных кислот RCOONa. В качестве Mn исп.KMnO4.
Активной формой кат-ра является его высшая валентная форма
4. Влияние скорости подачи воздуха. Обычно она составляет 60-70 м3 на одну тонну парафина. Избыток воздуха приводит к увеличению теплового эффекта
5. Влияние времени окисления и глубины окисления. Оптимальными условиями считаются время окисления 15-20 часов, Р=0,2 МПа, скорость подачи воздуха 0,1 м/с, переменный температурный режим.
Технология окисления нефтяного парафина в СЖК. Исходный парафин смешивается с кат-ром и рециркулятом в емкости 1. Соотношение свежего парафина и рециркулята 1:2 (окислительная шихта). Окислительная шихта подается в полый реактор 2, снабженный распределительным устройством для подачи воздуха и рубашкой для подогрева и охлаждения. Отработанный воздух сверху выводится на промывку в скруббер 3, затем отправляется на дожигание в печь 4 и затем сбрасывается в атмосферу.
Оксидат с низа колонны 2 поступает в шламоотделитель 5 и затем поступает в промывную колонну 6 для удаления водорастворимых низших кислот. Смесь кислот и др. кислородсодержащих продуктов поступает в омылитель 7, где происходит взаимодействие с водным раствором соды. В результате свободные кислоты переводятся в мыло. Омыление необходимо, чтобы предотвратить образующиеся кислоты при их выделении от деструкции и дальнейшего окисления, увеличить расход кислот, т. к. на стадии омыления переводятся в мыло не только свободные кислоты, но и другие кислородсодержащие продукты.
2RCOOH + Na2CO3 → 2RCOONa + H2O + CO2; В аппарате 8 подвергаются омылению эфиры водным раствором щелочи. RCOOR’ + NaOH → RCOONa + R’OH Реакционная смесь подогревается в теплообменнике 9 и поступает в автоклав 10, где происходит выделение неомыляемых продуктов. Они возвращаются в узел приготовления окислительной шихты. Т= 180°С, Р= 2 МПа. Омыление оставшихся кислородсодержащих продуктов завершается в трубчатой печи 11 при более жестких условиях (380°С; 2,5 МПа). Здесь переводят в мыло кетоны и лактоны. Далее смесь проходит дросселирующий клапан, в результате чего в сепараторе 12 выделяется мыло и УВ-часть отдает свое тепло в теплообменнике 9. В сепараторе 12 из нее выделяется вода, а сами они в виде 2-х неомыляемых продуктов выводятся для последующего их выделения с последующим гидрированием. Мыло подается шнеком, добавляя воду для получения мыльного клея. Мыльный клей поступает на разложение серной кислотой в аппарат 15.
2RCOONa + H2SO4 → 2RCOOH + Na2SO4
В аппарате 16 от СЖК отделяют Na2SO4, а СЖК отправляют на вакуумную ректификацию для разделения по фракциям.
Недостатки: образование малоценного Na2SO4, периодичность, потери низших кислот с промывными водами. Пути совершенствования: перевод на непрерывный процесс; использование СО2, выделяющийся в процессе для перевода мыла в кислоты; улавливание низших кислот; использование малоценного кубового остатка (выше С20).
В-37. Жидкофазное окисление аренов.
Осн. реакциям являются:
1. Окисление алкил бензолов до гидропероксидов с последующим их кислотным разложением на фенол и кетоны:
С6Н5СН(СН3)2+O2→С6Н5С(ООН)(СН3)2+H+→С6Н5ОН+(СН3)2СО
2.Окисление метилбензола в кислоту С6Н5СН3+О→С6Н5СНО→ С6Н5СООН
Рассмотрим 1. пример:
Окислению в гидропероксиды подвергают преимущественно кумол и реже изопропилнафталин и диизопропилбензол. Этот метод лег в основу кумольного метода получения фенола и ацетона. Процесс идет по свободно-радикаьному механизму в отсутствии кат-ра, т.к. они разлагают образовавшиеся гидропероксиды. Для сокращения индукционного периода в исходную смесь добавляют 3-4% гидропероксида окисляемого УВ. В связи с этим механизм можно представить так:
С6Н5СН(СН3)2+ROO• →С6Н5C•(СН3)2+ ROOH +О2→ С6Н5СОО•(СН3)2→С6Н5СОСН3+СН3О•
+RH|___________→С6Н5С(ОOH)(СН3)2 + R•
Присоединение гидропероксидной группы происходит по третичному УВ-ному атому с образованием побочных продуктов (ацетофенон и фенилкарбинол) С6Н5С(ООН)(СН3)2+С6Н5С(СН3)2→
→С6Н5С(ОН)(СН3)2 +С6Н5С (О•)(СН3)2
Разложение осуществляется в присутствии кат-ра кислотного типа при Т=40-60°С. Механизм сложно-ионный. Первоначально протонируется молекула гидропероксида, затем отщепляется вода, происходит миграция кислорода к фенольной группе, затем происходит присоединение воды; внутримолекулярное перемещение зарядов и завершается процесс деструкции с образованием фенола и ацетона и регенерацией протона водорода.
С6Н5С(СООН)(СН3)2+H+↔С6Н5С(ООН+2)(СН3)2+Н2О↔С6Н5С(О)(СН3)2→С6Н5ОС+(СН3)2+Н2О→
→С6Н5ОС(ОН2+)(СН3)2→С6Н5О+(Н)С(ОН)(СН3)2→ →С6Н5ОН+ (СН3)2СО+Н+
Разложение гидроперекиси может осуществляться в различных реакционных узлах:
![]()
1.Прямоточная циркуляционная система
Процесс экзотермичный выделяющееся тепло снимается водой. Этот процесс неперспективный и имеет ряд недостатков: низкая доля полезного объема , в следствие рециркуляции высокое время реакции, дающее образование побочных продуктов, высокая металлоемкость.
2. Наиболее перспективный горизонтальный аппарат с секционированными перегородками

Тепло снимается ацетоном
Тех. схема кумольного метода получения фенола и ацетона.
Технология состоит из 3-х стадий: 1.Алкилирование бензола пропиленом; 2. Окисление; 3.Разложение.
Окисление кумола проводят воздухом в секционированной колонне1, в к-ой установлены змеевики для поддержания переменного теплового режима по высоте колонны. В верхнюю часть колонны подается сырье с Т=120°С с постепенным понижением Т до 105-110°С. Т.к. происходит увеличение содержания гидроперекиси, а следовательно и возможности ее деструкции. Окислительная шихта готовиться в аппарате 5, куда подается свежий и непревращенный ИПБ и гидроперекись. Шихта подогревается в теплообменнике 6 и идет в верхнюю часть К-1. С воздухом обененным О2 носится часть непревращенного ИПБ и легкие побочные продукты. Они охлаждаются в холодильнике 2. Конденсат отделяется в сепараторе 3 и стекает в прмывную колнну 4. откуда сверху углеводородный слой поступает в емкость приготовления шихты 5, а вода идет в стоки. Оксидат содержащий 28-30 % гидропероксида охлаждается исходной смесью в теплообменнике 6. затем сбрасывается Р до 4 кПа и поступает в узел укрепления 7. Там происходит отгонка неревращенного ИПБ, к-ый отправляется на промывку в К-4. Узел укрепления состоит из 2-х последовательно работающих насадочных колонн. В первой из них Р=4кПа, гидроперекись укрепляется до 70-75%; во второй колонне Р=600-605Па гидроперекись укрепляется до 88-92%. Укрепленная гидроперекись идет в узел кислотного разложения 8, работающего по одному из указанных методов. Далее продукты разложения обрабатываются щелочью, образующиеся сульфаты выделяются в сепараторе 9.Далее продукты разложения идут в К-10, где происходит разложение ацетонового и фенольного потоков, каждый из которых проходит систему колонн для получения товарных продуктов. В случае выделения фенола легкими примесями является ИПБ и ацетофенон, а тяжелыми- различные смолы. Помимо фенола и ацетона м/о получить ряд др. продуктов. Например, двухатомные фенолы. (гидрохинон и резорцин).
В-38. Гетерогенно-каталитическое окисление.
Гетерогенно-каталитическое окисление имеет место при синтезе следующих продуктов:
1. Получение акролеина, метакролеина и их кислот. Окисление осуществляют по насыщенному атому углерода олефинов. При этом двойная связь сохраняется. Например, окисление пропилена в акролеин и акриловую кислоту.
СН2=СН-СН3 + О2 – H2O → СН2=СН-СНО + 0,5О2 → → СН2=СН-СООН
2.Синтез акрилонитрила окислительным аммонолизом, где происходит взаимодействие олефинов с аммиаком в присутствии кислорода
RCH3 + NH3 +1,5O2 → RCN + 3 Н2О ; R: CH2=CH-
3.Окисление аренов с образованием ангидридов ди- и тетрокарбоновых кислот.
![]()
4. Синтез α-оксидов окислением олефинов.
СН2=СН2 + 0,5О2 → α-оксид
Кат-ры гетерогенно-каталитического окисления.
1. металлы (Ag, Cu);
2. Оксиды металлов ( CuO, Cu2O, V2O5);
3. Сложные катализаторы ( ванадаты, вальфроматы) - представляют смесь оксидов, иногда солей: ZnO* V2O5*CoWO3. Носитель-пемза, Al2O3.
Механизм гетерогенно-каталитического окисления.
В основу катализа положена хемосорбция реагента на поверхности кат-ра.
Ag + О2 → Ag-O-O˙- + Ag → 2Ag-O˙-
На поверхности оксидного и солевого кат-ра кислород сорбируется слабо
Сорбция УВ: УВ сорбируются на поверхности Ме слабо и необратимо. Прочнее они сорбируются на оксидных и солевых Кат.
Ме(n+1)+ + CH2=CH-CH3→ Меn+ + -CH2-CH˙+-CH3
В результате совместной сорбции О2 и УВ кат-р накапливается разных валентных состояниях.
Реакторы гетерогеннокаталитического окисления. Гетерогенно-каталитическое окисление ведут под давлением от 0,3-2МПа для сокращения размеров оборудования. Т=250-350°C либо 400-500°C. В качестве реакторов используются колонные аппараты, изготовленные из высоколегированной стали. УВ с О2 образуют взрывоопасные смеси, для избежания взрыва используют следующие приемы:
1) Окисление рециркулирующими газами с добавкой свежего воздуха или О2 при низкой концентрации УВ (3-5%).
2) Использование избытка УВ при небольшом содержании воздуха или технического кислорода.
3) Разбавление водяным паром. Водяной пар также играет роль теплоносителя, способствует газификации отлагающихся смол и кокса, в результате чего образуется СО2+Н2О. А также водяной пар способствует десорбции продуктов реакции с поверхности Каt .
Ввиду высокой экзотермичности процессов нашли применение следующим конструкциям реакторов:

(а) Кожухотрубный р-р. Используется в том случае, когда применяется дорогой kаt и в реакциях с псевдоожиженным слоем kаt будет уносится «–» – высокая металлоемкость, низкая доля полезного объема, невозможность создания изотермического режима.
(б) Несекционированный р-р. С псевдоожиженным слоем kаt с внутренним змеевиком и батареями циклонов в верхней части для улавливания частиц Каt . Эти реакторы работают без регенератора, т.к. образование смол и кокса незначительно и kаt мажет работать до 9 лет. «+»: хороший массо- и теплообмен, возможность создания изотермического режима «-»: унос kаt, отрицательный эффект продольного перемешивания способствует развитию побочных реакций.
(в) Секционированный р-р. с псевдоож-ным слоем kаt. Меньше продольное перемешивание из-за секций.
(г) Реактор с восходящим потоком кат-ра, продукты вместе с kаt поднимаются по восходящей трубе; там они охлаждаются водным конденсатом, затем Каt отделяется от продуктов в бункере или сепараторе и возвращается в нижнюю часть р-ра (дозатор).
В-39. Процессы синтеза на основе оксида углерода.
Основаны на использовании синтез-газа, широко распространенны, т.к. в этих синтезах используется дешевое сырье. Они реализованы в следующих направлениях: 1) Синтезы непосредственно из CO и H2 с получением смеси УВ и O-содержащих соединений. 2) Процессы оксосинтеза или гидроформилирования, процессы карбоксилирования, где помимо синтез газа используются олефины.
1) направление:
1. Синтез смеси УВ, к-ые получают на Ni кaт-ре при Т>200°C. Этот процесс впервые был разработан Фишером и Тропшем в 1923г. CO + 3H2 ↔ CH4 + H2O
На оксиде железа при P=3МПа была синтезирована смесь УВ, называемая когазином.
2nCO + (n+1)H2 → CnH2n+2 + nCO2
До разработки нефтяных месторождений этот процесс широко использовался для получения синтетического бензина, выделяемого из когазина в виде узкой бензиновой фракции.
2. при P=10-15МПа на ZnO впервые были синтезированы О-содержащие соединения из синтез-газа при Т=250-300°С, из к-ых наибольшую ценность представляет CH3OH. CO + 2H2 ↔ CH3OH;
С тех пор этот метод получения метанола явл-ся единственным в промышленности.
Производство метанола.
Метанол явл-ся многотонажным продуктом и используется, как в виде целевого, так и промежуточного продукта. В виде целевого используется, как растворитель или высокооктановая добавка. В виде промежуточного, как метилирующий агент в производстве метиловых эфиров и метиламинов, в производстве формальдегида и МТБЭ. Ткип(CH3OH)=64,7°С,
Синтез CH3OH протекает по обратимой экзотерм-ой реакции.. Синтез идет с уменьшением объема, поэтому для сдвига равновесия вправо нужно увеличить давление до5-40МП, при всех Т повышенное давление благоприятно сказывается на выходе метанола. Долгое время в качестве кат-ра использовалась смесь ZnO и CrO в соотношении 8 : 1. Механизм действия такого кат-ра:
K + CO↔K:::C=O + H2↔K:::CH-OH + H2↔K + CH3OH
Хемосорбированные частицы имеют св-ва радикала.
Реакционные узлы синтеза метанола

а) Трубчатый реактор, где тепло отходящих продуктов исп-ся для подогрева исходных реагентов;
б) Адиабатический реактор секционированный, где на решетках установлены перфорированные корзины заполненные кат-ра. Тепло реакции снимается за счет подачи между слоями кат-ра синтез-газа. Это самая распространенная конструкция, к-ая позволяет вести процесс в изотермич-ком режиме без перегрева Ф=95%;
в) Представляет собой трехфазную систему, в к-ой осуществляется синтез в инертном растворителе, на суспензированном в нем гетерогенном кат-ре. Через эту суспензию барботируется синтез-газ. Такая система позволяет доводить конверсию до 35%, использовать синтез-газ меньшей чистоты и вести процесс в изотермическом режиме.
Технология производства метанола.
В современных установках обычно совмещается установка получения синтез-газа с установкой получения метанола. УВ-ный газ сжимается компрессором 1 и поступает в конвертор 2 для поучения СО и Н2. Т.к. Т в конверторе высокая, синтез-газ охлаждается в котле утилизаторе 3 с выработкой пара высокого давления, далее в холодильнике 4 и сжимается компрессором 5 до рабочего давления. Далее газ идет в адсорбер 7 для удаления из синтез-газа пентакарбонила железа Fe(CO)5, к-ый образуется при взаимодействии СО с трубами при высоком давлении и разлагается, образуя мелкодисперсное железо, к-ое катализирует побочные реакции. Далее синтез-газ делится на два потока: холодный подается между слоями кат-ра в реактор 8, а другой поток подогревается отходящими продуктами реакции в теплообменнике 9 и также поступает в реактор 8. Получаемые продукты реакции на выходе из реактора также делятся на два потока: один поток греет исходное сырье, тепло второго потока используется в котле-утилизаторе 10 для выработки пара. Далее продуктовые потоки объединяются, охлаждаются в холодильнике 11, в сепараторе 12 происходит разделение продуктов и синтез газа.
Далее синтез-газ дожимается компрессором 6 и возвращается в процесс. Продукты реакции из сепаратора 12 дросселируются и поступают в колонну 13, где при давлении, близком к атмосферному, отгоняются первоначально легкие фракции, а в колонне 14 из CH3OH отделяют тяжелые примеси. Выход CH3OH = 90-95%.
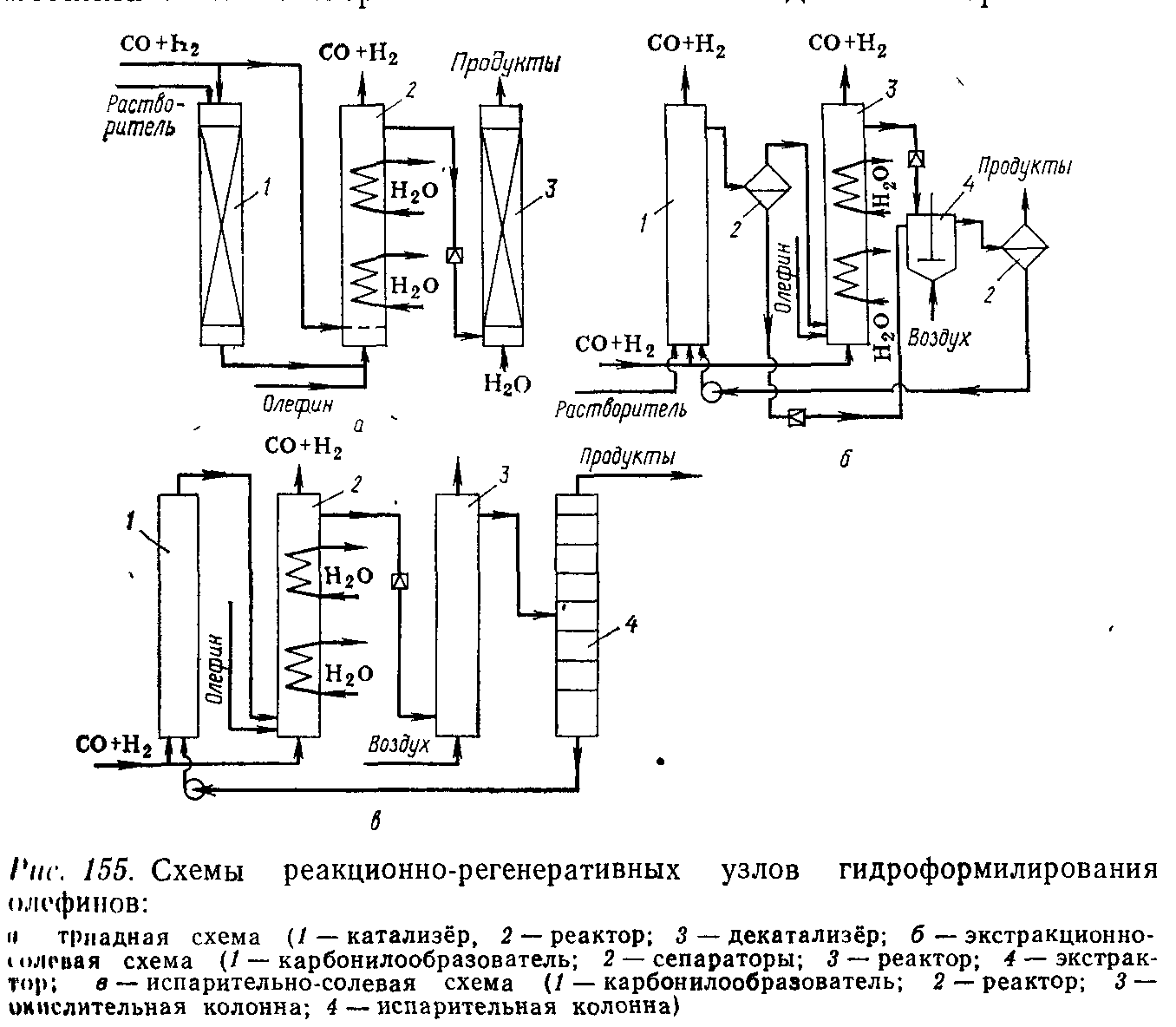
В-40. Процессы гидроформилирования.
Это процесс взаимодействия синтез-газа с олефинами, где происходит присоединение по двойной связи атома С и формильной группы с другой стороны, поэтому эти процессы называют гидроформилированием. эти процессы имеют значение для производства альдегидов, к-ые сами по себе большого интереса не представляют и тут же на установке подвергаются гидрированию с получением спиртов. Чаще получают следующие спирты: С4 – производство растворителя; С7-9 – для производства пластификаторов; С10-18 – для произ-ва ПАВ.
RCHO + H2 → RCHOH Для получения ROH используют олефин с числом атомов С на 1 меньше, чем у получаемых ROH. Реакционная способность олефинов с удлинением цепи изменяется так: CH2= CH2 > CH3CH=CH2 > (CH3)2C=CH2
Причем формильная группа присоединяется к углеродному атому при двойной связи.
(CH3)2C=CH2 + CO + H2 → (CH3)2-CH2-CH2OH Введение молекулы кислорода в молекулу олефина проводят с помощью реагентов: H2O, O2 и CO. Реакции протекают в присутствии kat-ов (карбонилов переходных Ме). При использовании α-оолефина образуются альдегиды, как н-, так и изо-строения. В качестве главного продукта образуются н-альдегиды.
Промышленное применение процессов гидрофор-ия.
1) Получение н-масляного ангидрида из пропилена и синтез-газа частично масляный альдегид путем гидрирования перерабатывают в бутиловый спирт, а остальную часть по реакции альдольной конденсации с последующим гидрированием 2-этилгексанола, который служит сырьем для производства эфира фталевой кислоты ( пдастификаторов ПВ).
2) Синтез высших спиртов из α- олефнов ( С8 и выше). Иногда процесс гидрофор-ия комбинируют с гидрированием, т.к модифицированные фосфинами корбонилкобольтовые кат-ры активны в этих реакциях.Получаемые при этом н-ВЖС применяются в производстве ПАВ. 3)Производство пропионового альдегида из пропилена. Гидрированием пропионового альдегида получают пропионовый спирт, а окислением – пропионовую к-ту.
Кат-ры: гидрокарбонилы переходных Ме, активность которых уменьшается в ряду: Rh>Co>Mg>Fe>Cn>Mo>W>Ni.(НСо(СО)4). Кат-р генерируется из тонкоизмельченного Ме или солей с использованием синтез газа при повышенной Т и Р.
Механизм гидрофор-ия на примере этилена.
1). Диссоциация кат-ра с образованием поляризационно – ненасыщенного комплекса НСо(СО)4↔НСо•(СО)3 + СО
2). Внедрение этилена по связи Со-Н.
НСо•(СО)3 + СН2=СН2 → НСо•(СО)3↔
↔ СН3СН2 Со•(СО)3 ↑
СН2=СН2
3). Происходит внедрение по связи Со-С с образованием алкилацилкарбонилСо, к-рый при взаимодействии с Н2 или с Кат образует альдегиды- продукты реакции.
СН3СН2Со•(СО)3++СО↔СН3СН2Со(СО)4↔
↔СН3СН2 СОСо(СО)3→ Ι, ΙΙ
Ι +H2→СН3СН2СОСо(Н2)(СО)3→
→СН3СН2СНО + НСо•(СО)3
ΙΙ +НСо(СО)4 →СН3СН2СНО + Со2(СО)7
4). Из Со2(СО)7 регенерируется кат-тор:
Со2(СО)7 + СО↔ Со2(СО)8 + Н2 ↔ 2НСо(СО)4
Параметры процесса.
Процесс протекает в гетерофазной среде при барабатировании синтез - газа ч/з жидкую реакционную массу.
Температура определяется типом используемого олефина: для низших- 140-150°С, для высших- 200°С. Повышение Т способствует увеличению скорости, а следовательно и повышению степени конверсии и развитию побочных реакций: 1).Гидрирование альдегидов до спиртов
СН3СН2СН2СНО + Н2 → СН3СН2СН2-СН2ОН; 2).Образование ацеталей
RСНО + 2RСН2ОН→ RСН(ОСН2R)2;
3).Образование кетонов
СН3СН2СНО + С2Н4→(С2Н5)2СО.
Поэтому степень конверсии поддерживают 65-80%, получая при этом выход альдегидов 75-85%- для низших; для высших- до95%.
Давление. Для низших олефинов 20-30 МПа, для высших- 45МПа. Для всех Т повышение Р благоприятно сказывается на увеличении скорости реакции до определенной оптимальной величины
Рециркуляция синтез–газа. Для подавления побочных реакций используется избыток синтез-газа с его последующей рециркуляцией.
Концентрация кат-ра. В зависимости от типа кат-ра получают различные соотношения нормальных и изоальдегидов: обыкновенный Со кат-р – соотношение нормальных к изоальдегидам 3-4:1; модифицированный Со Кат-р 7-8:1; родиевый кат-р 12-15:1.
Реакционные узлы
ТРИАДНАЯ СХЕМА. В катализере на насадке находится Ме- ий Со. При пропускании через к-ый синтез – газа образуется активный гидрокарбонилы Со, растворимые в у/в или в случае низших олефинов – в растворителе. Активная форма кат-ра из катализера подается в нижнюю часть реактора, куда подается оставшийся синтез – газ. В реакторе протекает реация гидроформилирования, которая является экзотермичной и необратимой. В реакторе установлены змеевики для снятия тепла от продуктов реакции. В сепараторе отделяется синтез – газ, к-ый поступает на рециркуляцию, а продукты реакции проходят через дроссель для понижения Р ; при том происходит разрушение карбонилов и гидрокарбонилов Со. В декатализере выдуваются подукты реакции, а Ме-ий Со осаждается на насадке. По мере накопления Со катализер и декатализер меняются местами. ЭКСТРАКЦИОННО - СОЛЕВАЯ.
В карбонилобразователе 1 происходит образование активной формы Со-го кат-ра при пропускании синтез – газа через Со-ую соль, поступающую из экстракционного узла 3. В реактор 2 подается оставшаяся часть синтез – газа, олефин и раствор Кат-ра из аппарата 1. В сепараторе выделяются непревращенный синтез – газ. А в экстракционном узле 3 кат-р отделяется от продуктов реакции с помощью химических реагентов. Выделившийся СоSО4 здесь же взаимодействуют с подоваемой натриевой солью с образованием нафтоната Со, к-ый возвращается в аппарат 1, а Na2SO4 отводится. ИСПАРИТЕЛЬНО – СОЛЕВАЯ.
В карбонилобразователе 1 образуется активная форма кат-ра при пропускании синтез–газа через Со-ую соль, поступающую из куба колонны 4. В реакторе 2 протекает реакция, куда поступает кат-р, синтез–газ, олефин. В сепараторе отделяется непревращеннный синтез- газ . Продукты реакции дросселируются, кат-р разрушается и выделившийся Ме-ий Со взаимодействует с кислотой, образующейся при окислении альдегида воздухом в аппарате 3. В колонне 4 из продуктов реакции выделяется Со-вая соль, к-ая возвращается в карбонилобразователь 1. ИСПАРИТЕЛЬНАЯ. Данный узел используется в случае стабильного кат-ра, который отделяется от продуктов реакции в колонне 2 и возвращается в реактор.
В-41.Процессы конденсации по карбонильной группе.
Это реакции альдегидов и кетонов с различными реагентами. Главное их назночении состоит в получении изопрена, капролактама и пентаэритрита.
Классификация:
1. По типу и количеству стадий протекания реакций
а).одностадийное: RR`CO + HCN ↔ RR`C(ОН)(CN)
б).двухстадийное
RR`CO + ROH↔ RR`C(ОН)(OR) ↔ RR`C(OR)(OR) + H2O
в).однастадийное присоединение азотистых оснований с внутримолекулярной дегидротацией
RR`CO + NH2X ↔ RR`C=NX + H2О
2.По типу присоединяющегося реагента
а).Реакции альдегидов и кетонов с основаними. В этом случае используется кат-р кислотного типа.
RCНО RCН(ОН+)→RC+НОН
б).Реакции альдегидов и кетонов со слабыми кислотами. В этом случае используется кат-р основного типа
. НО- + НА→ А- + Н2О
Нуклеофил способен взаимодействовать с нуклеофилом или кетоном с образованием промежуточного продукта, к-ый взаимодействует с реагентом с образованием продуктов р-ции и регенерации нуклеофила.
3. По величине теплового эффекта.
а). высокоэкзотермичные реакции ∆Н= 104-106 кДж/моль являются необратимыми и характерны при взаимодействии альдегидов и кетонов с ароматикой и олефинами.
б). низкоэкзотермичные реакции ∆Н = 20кДж/моль являются обратными. Характерны при взаимодействии альдегидов и кетонов с азотистыми основаниями или в случае альдольной конденсации.
ПРОИЗВОДСТВО ИЗОПРЕНА
Изопрен получают по р-ции Принса при взаимодействии альдегида с олефином. Процесс осуществляется в 2 стадии. На 1 стадии в присутствии Н2SО4 протекает конденсация изобутилена с формальдегидом. Соотношение исходных реагентов изобутилен: формальдегид = 0,73:1 для избежания побочного продукта – третбутилового спирта. Т=85-95°С; Р=0,5-2 МПа; селективность 85-90%
Альдольная конденсация. Это реакции альдегидов и кетонов по уже имеющейся карбонильной группе. Кат-ры используются основного типа, роль к-ых заключается в переводе карбонильного соединения в сопряженное ему основание, т.о его активизируя, повышая его реакционную способность с реагентом.
Этот процесс протекает в 2 стадии:
Ι) Перевод реагента в активное состояние:
ОН- + Н-СН2-С НО ↔ Н2О + С-δН2-СНО
Как правило активизируется α- углеродный атом по отношению к карбонильной группе.
ΙΙ). ־СН2-СНО + R-СНО↔ R־СН –СН2-СНО→
→RСН(ОН)-СН2-СНО При взаимод. альдегида с альдегидом первая реакция – лимитирующая, при взаимод. альдегида с кетоном лимитирующая- вторая стадия.
Основные продукты альдольной конденсации.
1). Пентаэритрит- продукт взаимодействия ацетальдегида с формальдегидом, используется для синтеза присадок, ПАВ и пластификаторов.
2). Бутанол- продукт конденсации ацетальдегида с последующей дегидротацией гидрированием, используется в производстве пластификаторов.
3). 2-этилгексанол, используется в производстве пластификаторов.
Технология производства продуктов альдольной конденсации.

1)Реактор-колонна периодического действия, где отгоняется непревращенный реагент, возвращенный в реактор, поддерживая т.о температурный режим: Т~30°С. τ = 2-3 часа. Степень конверсии 10-40 %. Такие условия определяются обратимостью реакции. На выходе продукты нейтрализуются органической кислотой и далее идут в зависимости от назначения процесса, на гидрирование– в случае получения диола, или на дегидратацию и последующее гидрирование – в случае получения спиртов.
2СН3-СНО СН3-СН(ОН)-СН2-СНО → Ι и ΙΙ
Ι СН3-СН(ОН)-СН2ОН ;
ΙΙ СН3-СН=С-СНО СН3СН2СН2СН2ОН;
2). Реактор змеевикового типа, где одновременно совмещается альдольная конденсация с дегидратацией и последующей разгонкой продуктов р-ций в ректификационной колонне.
Т=100-130°; τ = 30мин-1час. По этой технологии получают 2- этиленгексанол.
3). Процесс протекает в реакторах периодического действия, оборудованных мешалками и рубашками в избытке щелочи. По этой технологии получают пентанэритрит. Т=30-50°С с постепенным повышением Т от реактора к реактору. τ = 1-2 часа.
