
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •8. Неорганические ионы. Активаторы ферментов. Простетические группы. Коферменты. Над. Надф.
- •Простетические группы
- •Коферменты (например, над, надф, ацетилкофермент а, атф)
- •Никотинамидадениндинуклеотид (над)
- •17. Переваривание и всасывание липидов
- •28/ См выше!
- •1. Восстановительное аминирование.
- •30. Взаимосвязь обмена углеводов, жиров, белков
- •Регуляция процессов обмена веществ в организме
1. Оксидоредукпшзы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз.
Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции:

Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
![]()
Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:

80
2.Трансферты
Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы). Примеры реакций (см. схему А).
3.Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза. Пример реакции (см. схему Б).
Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др.
4. Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов составляют по формуле "субстрат-отщепляемая или присоединяемая группировка". Примеры реакций (см. схему В).

Схема А

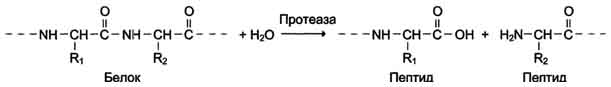
Схема Б

Схема В
81
5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Как общее название ферментов этого класса применяют термин "изомеразы", например (см. схему А).
Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы (см. схему Б).
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой", например (см. схему В).
6. Лигазы (синтетазы)
Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г).
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами (см. схему на с. 83).

Схема А

Схема Б

Схема В

Схема Г
82
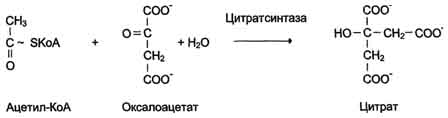
Схема
2.Сложность строения ферментов. Механизм ферментативного катализа
Сложность строения Ферменты по химической природе – этот белки. В отличие от белков у ферментов имеется активный центр (АЦ). АЦ – это уникальная для каждого фермента совокупность функциональных групп аминокислотных остатков, строго ориентированных в пространстве за счет третичной или четвертичной структуры фермента. В АЦ различают субстратный и каталитический участки. Субстратный – это «руки» фермента. Он обуславливает субстратную специфичность фермента, т.е. сродство фермента к субстрату. Субстрат - это вещество, на которое действует фермент. Раньше считали, что взаимодействие фермента и субстрата происходит по типу «ключ к замку», т.е. АЦ фермента должен точно соответствовать субстрату, как ключ к замку. Сейчас считается, что точного соответствия между ферментом и субстратом нет, оно возникает в процессе взаимодействия фермента с субстратом (теория вынужденного соответствия). Второй участок в АЦ – каталитический. Он обуславливает специфичность действия фермента, т.е. тип ускоряемой реакции.
По строению все ферменты можно разделить на однокомпонентные (простые, или ферменты-протеины) и двухкомпонентные (сложные, или ферменты-протеиды). Ферменты-протеины построены по типу простых белков – состоят только из аминокислот. Ферменты-протеиды состоят из белковой части –апофермента и небелковой части – кофермента.Апофермент обуславливает субстратную специфичность, т.е. играет роль субстратного участка АЦ, а кофермент играет роль каталитического участка АЦ, т.е. обуславливает специфичность действия. Коферментами могут быть металлы, витамины и другие небелковые низкомолекулярные вещества.
Некоторые ферменты, имеющие четвертичную структуру помимо АЦ могут иметьаллостерический центр. Он служит для регуляции активности ферментов.
3. Влияние температуры
Температура, при которой наблюдается максимальная активность ферментов, называется оптимальной. Для большинства ферментов оптимальной температурой является температура от +35С — +45С. Если фермент поместить в условия, ниже оптимальной температуры, будет происходить снижение его активности, такое состояние называется обратимой инактивацией фермента, т.к. если вновь поднять температуру до оптимальной, активность фермента возобновится. Если поместить фермент в условия, где температура будет выше оптимальной, то также будет прроисходить снижение его активности, но в данном случае необратимая инактивация, т.к. если понизить температуру до оптимальной, активность фермента не возобновится. Это объясняется тем, что высокая температура вызывает денатурацию молекулы фермента.
Влияние рН среды
рН среды влияет на заряд молекулы фермента, а значит на работу АЦ. Оптимальная рН для каждого фермента своя, но для большинства ферментов от 4 до 7. Например, для альфа-амилазы слюны опт.рН равна 6,8. Имеются исключения, например, для пепсина опт.рН равна 1,5-2,0; для трипсина и химотрипсина опт.рН равна 8-9.
4,5. Активация ферментов. Активация ферментов – это увеличение скоро-
сти биохимической реакции в результате действия модификатора. Модифика-
торами могут выступать соединения различной природы: коферменты, ионы
металлов и субстраты. Кофакторы являются не только структурными элемен-
тами ферментов, но и их активаторами. Активация кофакторами объясняется
спецификой их участия в связывании субстрата, и, собственно, в катализе. Осо-
бенно заметно активирующее влияние кофакторов при действии на фермент,
который не насыщен кофакторами.
Ионы металлов являются довольно специфичными активаторами. Часто
для некоторых ферментов требуются ионы не одного, а нескольких металлов.
Например, для фермента Na+, K+
-АТФаза, который осуществляет перенос одно-
зарядных катионов через клеточные мембраны, в качестве активаторов необхо-
димы ионы магния, натрия и калия. Активация ионами металлов осуществляет-
ся по разным механизмам. В некоторых ферментах они входят в состав катали-
тического участка. В ряде случаев ионы металлов облегчают присоединение
субстрата к активному центру фермента за счет образования дополнительных
связей. Иногда ион металла соединяется с субстратом, образуя своеобразный
металлосубстратный комплекс, который предпочтителен для действия фермен-
та.
В случае активации фермента самим субстратом, активность фермента
после достижения насыщающей концентрации субстрата не возрастает. Суб-
страт, как активатор, повышает стабильность фермента и облегчает формиро-
вание необходимой конформации активного центра фермента.
Для протеолитических ферментов характерен механизм активации путем
частичного протеолиза, т.е. отщепления части полипептидной цепи фермента в
результате неферментативного или ферментативного гидролиза. Такой способ
активации имеет очень важное физиологическое значение для пищеваритель-
ных ферментов, которые образуются из неактивных форм (проферменты)
именно благодаря механизму активации частичным протеолизом (см. главу 12
Раздела II).
Ингибирование ферментов. Ингибирование ферментов представляет
большой практический интерес для понимания механизмов ферментативного
катализа, строения активных центров ферментов и является инструментом изу-
чения роли отдельных химических реакций при расшифровке механизма дейст-
вия различных ингибиторов, например, лекарственных препаратов, ядохимика-
тов и др.
Следует различать смысл терминов «ингибитор» и «инактиватор». Об
«инактивации» правильнее говорить в случае торможения реакции под дейст-
вием агентов, денатурирующих фермент. Но следует отметить, что нередко ве-
щество в небольших концентрациях является ингибитором, а в больших – инак-
тиватором.
Процесс ингибирования ферментов может носить как обратимый, так и
необратимый характер. При необратимом ингибировании ингибитор настолько
прочно связывается с ферментом, что это вызывает стойкие (необратимые) из-
менения активности фермента. Примером необратимого ингибирования может
служить действие нервнопаралитических ядов на ацетилхолинэстеразу, иг-
рающую важную роль в процессах передачи нервных импульсов. Например,
одно из таких отравляющих веществ – диизопропилфторфосфат – взаимодей-
ствует с остатком серина в активном центре фермента с образованием прочного
неактивного комплекса диизопропилфосфорил-фермент: 88
Фермент
Диизопропилфторфосфат Диизопропилфосфорил-фермент
При обратимом ингибировании равновесие между ингибитором и фер-
ментом устанавливается довольно быстро. Комплекс фермент-обратимый ин-
гибитор довольно лабилен, вследствие чего быстро диссоциирует, при этом ак-
тивность фермента восстанавливается. Примером обратимого ингибирования
является образование молекулярного комплекса монооксида углерода СО с ге-
мом гемоглобина, который может быть разрушен введением избытка в орга-
низм кислорода.
Классическими вариантами ингибирования являются: конкурентное, не-
конкурентное, бесконкурентное и субстратное ингибирование.
Конкурентное ингибирование. Конкурентные ингибиторы вызывают
торможение ферментативной реакции за счет структурного сходства молекулы
ингибитора с молекулой субстрата. В этом случае ингибитор и субстрат, буду-
чи схожими по строению, конкурируют между собой за активный центр фер-
мента. Ингибирование наступает вследствие того, что ингибитор в силу боль-
шего стехиометрического соответствия связывает часть молекул фермента в
ингибитор-ферментные комплексы, лишая тем самым субстрат возможности
взаимодействовать с истинным ферментом.
Cкорость ферментативной реакции в случае полного конкурентного ингибиро-
вания будет определяться из следующего уравнения:
В этом случае зависимость в координатах Лайнувера-Берка имеет вид пучка
прямых, пересекающихся в точке на оси ординат (табл. 10), здесь КI – кон-
станта конкурентного ингибирования, т.е. константа диссоциации комплекса
фермент-ингибитор (EI), которая отражает сродство ингибитора к ферменту:
чем меньше КI , тем сильнее действие ингибитора.
Классическим примером конкурентного ингибирования является дейст-
вие малоната на сукцинатдегидрогеназу – фермент, отщепляющий от сукцината89
ионы водорода. Малонат отличается от сукцината лишь тем, что содержит
вместо двух одну метиленовую группу:
Сукцинат Малонат
Снять конкурентное ингибирование можно избытком субстрата, вытесняющего
ингибитор из активных центров фермента и тем самым повышающего его ак-
тивность.
Избирательно выключая тот или иной фермент, можно проводить свое-
образный анализ участия конкретного фермента в обмене веществ. Явление
конкурентного ингибирования открывает возможности для поиска антиметабо-
литов – конкурентных ингибиторов, перспективных в качестве специфических
лекарственных веществ. Таким способом были открыты сульфаниламидные
препараты, молекулы которых сходны по структуре с п-аминобензойной кисло-
той (ПАБК), используемой бактериями для синтеза фолиевой кислоты – кофак-
тора бактериальных ферментов. Замена ПАБК на молекулу сульфаниламида
останавливает синтез фолиевой кислоты, блокируя развитие последующих ме-
таболических стадий.
Изучение механизмов конкурентного ингибирования довольно успешно
применяется в медицинской практике. Так, например, щавелевая кислота явля-
ется сильнейшим ядом для организма человека. Она образуется в результате
окисления этиленгликоля – добавки в антифриз для автомобильных двигателей.
При отравлении этиленгликолем ежегодно в мире погибает около 50 человек.
Этиленгликоль окисляется в щавелевую кислоту в несколько этапов, первый из
которых заключается в окислении этиленгликоля до альдегидного производно-
го:
Данная реакция катализируется ферментом алкогольдегидрогеназой. Эту реак-
цию можно эффективно затормозить путем введения большой, почти токсиче-
ской дозы этанола. Этанол является конкурентным ингибитором алкогольде-
гидрогеназы и тем самым предотвращает окисление этиленгликоля в альдегид-
ное производное. В результате этиленгликоль выводится, не причиняя вреда
организму. Этот же принцип лежит в основе лечения отравлений метанолом.
Неконкурентное ингибирование. Неконкурентное ингибирование вы-
зывается веществами, не имеющими структурного сходства с субстратом и свя-
зывающимися с каталитическими группами активного центра или с другими
фрагментами молекулы фермента таким образом, что это затрагивает структуру
каталитического центра, мешая взаимодействию с ним субстрата. Неконку-
рентное ингибирование приводит к образованию тройного комплекса фер-90
мент–субстрат–ингибитор, однако, дальнейшего превращения этого ком-
плекса в продукты не происходит:
Зависимость в координатах Лайнувера – Берка представляет собой пучок пря-
мых, пересекающихся на оси абсцисс (табл. 10).
Примером неконкурентного ингибитора являются анионы СN−, которые
прочно связываются ионом Fe3+, входящим в каталитический участок гемино-
вого фермента – цитохромоксидазы. Блокада этого фермента выключает дыха-
тельную цепь, и клетка погибает. Токсичность действия ионов тяжелых метал-
лов (ртути, свинца, кадмия, мышьяка) и их органических соединений также
обусловлена неконкурентным ингибированием, механизм которого заключает-
ся в блокировании сульфгидрильных групп каталитического участка фермента
(подробнее о токсичном действии различных ионов металлов см. в главе 4 на-
стоящего Раздела). Снять действие неконкурентного ингибитора избытком суб-
страта нельзя, а можно лишь веществами, прочно связывающими ингибитор –
реактиваторами (рис. 14).
Бесконкурентное ингибирование. Бесконкурентным ингибированием
называется торможение ферментативной реакции, вызванное присоединением
ингибитора только к комплексу фермент–субстрат с образованием «тупико-
вого продукта
Такой ингибитор не присоединяется к ферменту в отсутствие субстрата и даже
способен облегчать присоединение субстрата, а затем, связываясь, сам инакти-
вирует фермент. В случае бесконкурентного ингибирования скорость фермен-
тативной реакции описывается более сложным уравнением, чем в случае кон-
курентного или неконкурентного типов ингибирования. В случае бесконку-
рентного ингибиторования график зависимости в координатах Лайнувера –
Берка имеет вид семейства параллельных прямых (табл. 10).
Субстратное ингибирование. Субстратным ингибированием называется
торможение ферментативной реакции, вызванное избытком субстрата. Такое
ингибирование происходит вследствие образования фермент–субстратного
комплекса, не способного подвергаться дальнейшим каталитическим превра-
щениям. Схема субстратного ингибирования выглядит следующим образом:
Е + 2S → ES2
Комплекс ES2 непродуктивен и делает молекулу фермента неактивной
6.cпецифичность действия – это способность фермента ускорять только определенную реакцию. Ферменты могут действовать на один и тот же субстрат, но каждый ускоряет только одну определенную реакцию с ним. Это можно проследить на примере мультиферментного комплекса, например, пируватдегидрогеназного. В этот комплекс входят ферменты, которые действуют на ПВК. Основными являются три фермента – 1) пируватдегидрогеназа (ускоряет дегидрирование ПВК, или ее окисление); 2) пируватдекарбоксилаза (ускоряет декарбоксилирование ПВК); 3) ацетилтрансфераза (присоединяет КоА). Реакция называется окислительным декарбоксилированием ПВК. Продуктом этой реакции является активная уксусная кислота (АУК) – суммарную реакцию знать см. учебник по алфавитному каталогу на «Декарбоксилирование пирувата, окислительное». Специфичность действия ферментов обуславливает каталитический участок АЦ, или кофермент в двухкомпонентных ферментах.
Факторы, влияющие на активность ферментов
7.В настоящее время витамины можно охарактеризовать как низкомолекулярные органические соединения, которые, являясь необходимой составной частью пищи, присутствуют в ней в чрезвычайно малых количествах по сравнению с основными её компонентами. Витамины - необходимый элемент пищи для человека и ряда живых организмов потому, что они не синтезируются или некоторые из них синтезируются в недостаточном количестве данным организмом. Витамины - это вещества, обеспечивающее нормальное течение биохимических и физиологических процессов в организме. Они могут быть отнесены к группе биологически активных соединений, оказывающих своё действие на обмен веществ в ничтожных концентрациях. Витамины делят на две большие группы: витамины, растворимые в жирах, витамины, растворимые в воде. Каждая из этих групп содержит большое количество различных витаминов, которые обычно обозначают буквами латинского алфавита. Следует обратить внимание, что порядок этих букв не соответствует их обычному расположению в алфавите и не вполне отвечает исторической последовательности открытия витаминов. В приводимой классификации витаминов в скобках указаны наиболее характерные биологические свойства данного витамина - его способность предотвращать развития того или иного заболевания. Обычно названию заболевания предшествует приставка "анти", указывающая на то, что данный витамин предупреждает или устраняет это заболевание. ^ 1. ВИТАМИНЫ, РАСТВОРИМЫЕ В ЖИРАХ.
Витамин A (антиксерофталический).
Витамин D (антирахитический).
Витамин E (витамин размножения).
Витамин K (антигеморрагический)
^ 2. ВИТАМИНЫ, РАСТВОРИМЫЕ В ВОДЕ.
Витамин В1 (антиневритный).
Витамин В2 (рибофлавин).
Витамин PP (антипеллагрический).
Витамин В6 (антидермитный).
Пантотен (антидерматитный фактор).
Биотин (витамин Н, фактор роста для грибков, дрожжей и бактерий, антисеборейный).
Инозит. Пара-аминобензойная кислота (фактор роста бактерий и фактор пигментации).
Фолиевая кислота (антианемический витамин, витамин роста для цыплят и бактерий).
Витамин В12 (антианемический витамин).
Витамин В15 (пангамовая кислота).
Витамин С (антискорбутный).
Витамин Р (витамин проницаемости).
Все вышеперечисленные - растворимые в воде -витамины, за исключением инозита и витаминов С и Р, содержат азот в своей молекуле, и их часто объединяют в один комплекс витаминов группы В
Номенклатура витаминов
В прошлом, когда химическая структура витаминов была неизвестна, по мере их открытия витамины обозначали соответствующими буквами (латинского) алфавита. Хотя многие витамины еще предстоит открыть, сегодня уже известны следующие витамины:
витамин А (ретинол, каротин);
витамины В-группы: В1 (тиамин), В2 (рибофлавин, обозначается также как витамин G), В3(ниацин, никотинамид, витамин РР), В4 (аденин) - пуриновое основание, которое входит в состав РНК, ДНК, нуклеотидов и играет важную роль в метаболизме, В5 (пантотеноваякислота), В6 (пиридоксин), В10, В11 (факторы роста), В12 (кобаламин, цианкобаламин), В13(оротовая кислота), В15 (пангамовая кислота), В17 (амигдалин), Вс (фолиевая кислота) - фолиевая кислота, известна также как витамин В9 или витамин М, Вt (карнитин) - Триметиламмониевое (бетаиновое) производное гамма-амино-бета-гидроксимасляной кислоты; ингибитор деятельности щитовидной железы, присутствующий в мышцах и печени, Вх или ПАБК (парааминобензойная кислота), холин, инозит;
витамин - С (аскорбиновая кислота);
D (кальциферол, эргокальциферол, эргостерол, виостерол);
Е (токоферол);
F (жирные кислоты);
G (рибофлавин);
Н (биотин) известный также как витамин В8;
К (менадион);
L (фактор лактации, необходимый для выработки молока);
М (фолиевая кислота), Р (биофлавоноиды), Р4 (троксерутин), Т (вещества, способствующие росту);
витамин U, содержащийся в капустном соке.
Существует и другая классификация витаминов, по которой наряду с витаминами известна группа витаминоподобных соединений. К ним относят холин, инозит, оротовую, липоевую и парааминобензойную кислоты, карнитин, биофлавоноиды (рутин, кверцетин, чайные катехины) и ряд других соединений, обладающих теми или иными свойствами витаминов. Витаминоподобные соединения не имеют, однако, всех основных признаков, присущих истинным витаминам, и, следовательно, таковыми не являются. В частности, холин и инозит, входя в состав соответствующих фосфолипидов, выполняют в организме пластическую функцию. Оротовая и липоевая кислоты, а также карнитин синтезируются в организме. Парааминобензойная кислота является витамином только для микроорганизмов, для человека и животных она биологически неактивна. Метил-метионинсульфония хлорид (витамин U) обладает терапевтическим эффектом при ряде заболеваний, но не выполняет каких-либо жизненно важных функций в организме. То же в значительной мере относится и к биофлавоноидам (витамин Р) - растительным фенолам, обладающим капилляроукрепляющим действием. Таблица 1. Классификация, номенклатура витаминов и их специфические функции в организме человека
