
- •2.Коррозиялық-активти орталар
- •3. Металдар мен ортаның температурасы, қысымның коррозия процесі жылдамдығына әсері
- •4. Мұнай-газ өндірісінде коррозиямен күресу тәсилдери
- •6.Мұнай-газ қондырғылары коррозиясындағы экологиялық мәселелер
- •7.Биокоррозия
- •8.Күкірттісутектік коррозияға сипаттама
- •9.Полимерные покрытия
- •10.Протекторная защита
- •Ингибиторы нейтральных сред: Нитрат натрия
- •2) Объемный показатель коррозии
- •1. Анодный процесс – переход металла в раствор в виде гидратированных ионов с оставлением эквивалентного количества электронов на поверхности металла:
- •2. Катодный процесс – ассимиляция появившихся в металле избыточных электронов какими-либо деполяризаторами (атомами, молекулами или ионами раствора), которые при этом восстанавливаются на катоде.
1. Анодный процесс – переход металла в раствор в виде гидратированных ионов с оставлением эквивалентного количества электронов на поверхности металла:
Me + mH2O → Men+ · mH2O + ne
Примерами таких процессов могут служить реакции окисления:
Zn + mH2O → Zn2+ · mH2O + 2e
Al + mH2O → Al3+ · mH2O + 3e
2. Катодный процесс – ассимиляция появившихся в металле избыточных электронов какими-либо деполяризаторами (атомами, молекулами или ионами раствора), которые при этом восстанавливаются на катоде.
Примерами катодных процессов могут быть следующие реакции восстановления:
H+ · H2O + e → ½ H2 + H2O
O2 + 2H2O + 4e → 4OH–
Fe3+ · mH2O + e → Fe2+ · mH2O
Наличие электронной проводимости металла и ионной проводимости у раствора позволяет, кроме того, анодным и катодным процессам протекать также и территориально раздельно. Поэтому в большинстве практических случаев протекание электрохимической коррозии обычно характеризуется локализацией анодного и катодного процессов на различных участках, - это второй, важный признак, отличающий электрохимический механизм коррозионного процесса от чисто химического.
Термодинамическая возможность протекания электрохимической коррозии может быть определена по изменению энергии Гиббса:
ΔGT = – nFET,
где F – число Фарадея; n – число электронов или химических эквивалентов, участвующих в реакции; ET – э.д.с. гальванического элемента, равная разности обратимых потенциалов, характеризующих катодную и анодную реакции:
ET = (φк)обр – (φа)обр
Коррозия возможна, если ΔGT < 0, т.е. если (φк)обр > (φa)обр. Принимая во внимание, что способность металла посылать свои ионы в раствор характеризуется значением обратимого потенциала в данных условиях, т.е. (φа)обр = (φМе)обр, протекание электрохимической коррозии металла термодинамически возможно при: (φМе)обр < (φк)обр.
Электрохимическое растворение металла возможно в случае присутствия в электролите деполяризатора (окислителя), обратимый потенциал которого положительнее обратимого потенциала металла в данных условиях.
Коррозияға қарсы металдардың қасиетін өзгерту тәсілдері
Есть 3 метода изменение свойств металла: - легирование металла - термообработка - поверхностная обработка (поверхностное легирование, ионная имплантация, аморфизация, пассивизация)
3. Леги́рование (нем. legieren — «сплавлять», от лат. ligare — «связывать») — добавление в состав материалов примесей для изменения (улучшения) физических и химических свойств основного материала. В металлургии легирование производится в основном введением в расплав или шихту дополнительных химических элементов (например, в сталь — хрома, никеля, молибдена), улучшающих механические, физические и химические свойства сплава. Для изменения различных свойств (повышения твёрдости, износостойкости, коррозионной стойкости и т. д.) приповерхностного слоя металлов и сплавов применяются также и разные виды поверхностного легирования. Легирование проводится на различных этапах получения металлического материала с целями повышения качества металлургической продукции и металлических изделий.
Способы легирования: Ионная имплантация, Нейтронно-трансмутационное легирование, Термодиффузия
2.Термическая обработка (термообработка) стали, цветных металлов - процесс изменения структуры стали, цветных металлов, сплавов при нагревании и последующем охлаждении с определенной скоростью. Термическая обработка приводит к существенным изменениям свойств стали, цветных металлов, сплавов. Химический состав металла не изменяется. Термическая обработка стали, сплавов бывает следующих видов: отжиг, нормализация, закалка, отпуск.
Отжиг - термическая обработка (термообработка) металла, при которой производится нагревание металла, а затем медленное охлаждение. Эта термобработка (т.е. отжиг) бывает разных видов (вид отжига зависит от температуры нагрева, скорости охлаждения металла).
Закалка - термическая обработка (термообработка) стали, сплавов, основанная на перекристаллизации стали (сплавов) при нагреве до температуры выше критической; после достаточной выдержки при критической температуре для завершения термической обработки следует быстрое охлаждение. Закаленная сталь (сплав) имеет неравновесную структуру, поэтому применим другой вид термообработки - отпуск..
Отпуск - термическая обработка (термообработка) стали, сплавов, проводимая после закалки для уменьшения или снятия остаточных напряжений в стале и сплавах, повышающая вязкость, уменьшающая твердость и хрупкость металла.
Нормализация - термическая обработка (термообработка), схожая с отжигом. Различия этих термобработок (нормализации и отжига) состоит в том, что при нормализации сталь охлаждается на воздухе (при отжиге - в печи).
3.Поверхностная обработка металлов включает в себя процессы, связанные со множеством вредных факторов. Эти методы поверхностной обработки металлов применяют главным образом для деталей небольших размеров и более или менее обтекаемой формы. Решающее значение имеет поверхностная обработка металлов перед склеиванием. Однако в этой области остается еще много невыясненных вопросов. Например, влияние шерохова-ния, результатом которого должно быть механическое заклинивание клея, не полностью объяснено. Существует точка зрения, согласно которой клей является прежде всего средством для выравнивания неровностей на поверхности субстратов. В то же время известно, что наиболее высокая прочность достигается лри склеивании металлов, подвергнутых травлению, причем разброс показателей наименьший, что свидетельствует о высокой воспроизводимости. Оставшиеся после травления неровности более мелкие, чем те, что остаются после механического шерохования. Среди прочих методов поверхностной обработки металлов метод нанесения лакокрасочных покрытий является наиболее распространенным и универсальным методом. В настоящее время применяют самые разнообразные способы поверхностной обработки металлов давлением. К таким способам относятся: 1) дробеструйный наклеп; 2) обкатка роликами или шариками; 3) чеканка; 4) наклеп при помощи ротационных упрочнителей и 5) гидроабразивный метод наклепа. Для получения более прочных покрытий перед окраской производится поверхностная обработка металла: фосфатирование, бондеризация или анодная обработка поверхности.
Коррозиялық ортадағы поляризациялық процестер
Поляризация электродных процессов.
На практике основным предметом исследования являются скорости коррозии. Чтобы правильно оценить влияние различных факторов на скорость коррозии, необходимо иметь данные о равновесном состоянии системы и учитывать то, что при протекании тока через электрод равновесное состояние его нарушается.
Рассмотрим элемент, состоящий из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4, соответственно (элемент Даниэля). Внешняя цепь включает переменное сопротивление R, вольтметр V и амперметр A. Учитывая, что электродный потенциал цинка будет около –1,0 В, а электродный потенциал меди около +0,1 В, разность потенциалов (Е) между цинковым и медным электродами в отсутствие тока близка к 1 В.
Начальное значение коррозионного тока на момент замыкания пары определится по формуле Ома:
Iнач
=
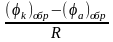
Однако, если омическое сопротивление пары (R) мало, то большое начальное значение величины силы тока (IНАЧ) после замыкания пары быстро падает и через определенное время устанавливается равным какой-то устойчивой величине (I′), во много раз меньшей первоначальной.
Так как омическое сопротивление существенным образом не изменяется (R = const), то наблюдаемое уменьшение силы тока можно объяснить только изменением потенциалов электродов и, соответственно, разности потенциалов. Изменение потенциалов происходит таким образом, что катод становится более отрицательным, а анод – более положительным и, следовательно, потенциалы электродов сближаются и разность между ними сильно уменьшается. Влияние силы тока в цепи на напряжение элемента можно графически изобразить с помощью поляризационной диаграммы (рисунок 9.1.), представляющей собой зависимость потенциалов медного и цинкового электродов от тока.
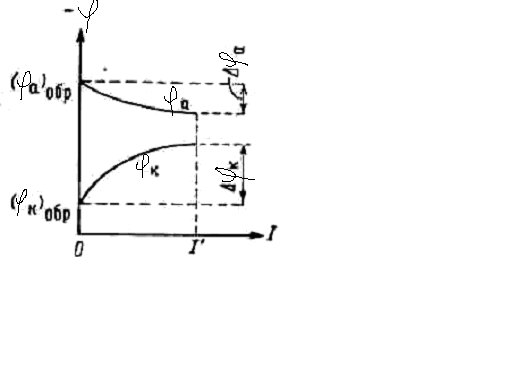
Рисунок 9.1. Поляризационная диаграмма элемента
Следует обратить внимание на то, что вверх по оси ординат отложены отрицательные значения потенциалов. Символами (φК)обр и (φа)обр обозначены потенциалы разомкнутого элемента, отвечающие отсутствию тока в цепи, ΔφК и Δφа – смещение потенциалов катода и анода, а φК и φа – так называемые эффективные потенциалы катода и анода при установившемся значении коррозионного тока I′.
φК = (φК)обр – ΔφК
φа = (φа)обр + Δφа
Установившееся значение силы тока I′ будет меньше начальной силы тока IНАЧ и может быть рассчитано по формуле Ома:
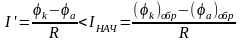
Уменьшение начальной разности потенциалов электродов гальванического элемента вследствие прохождения через него тока, приводящее к уменьшению величины тока после его замыкания, называется поляризацией коррозионного элемента. Анодная поляризация – смещение потенциала анода в положительную сторону при прохождении анодного тока. Катодная поляризация – смещение потенциала катода в отрицательную сторону при прохождении катодного тока.
Сущность явления поляризации сводится к тому, что перемещение электронов (отток от электрода при анодной поляризации и приток к электроду при катодной поляризации) совершается быстрее, чем электродные реакции.
Поляризация тормозит работу локального элемента и уменьшает скорость электрохимической коррозии.
Чтобы изучить скорость и характер электродных процессов, измеряют потенциал электрода в зависимости от плотности проходящего через него тока, получая при этом анодные или катодные поляризационные кривые. Графики такой функциональной связи широко используют при изучении процессов электрохимической коррозии.
Анодная поляризация
В зависимости от причин, обусловливающих анодную поляризацию, различают три основных случая:
1. Электрохимическая поляризация – торможение электродного процесса за счет затруднений в протекании электродной реакции. В случае если электродным процессом является анодное растворение металла по реакции
Ме + mН2О → Меn+∙ mH2O + ne,
торможение анодного процесса называется перенапряжением ионизации металла и определяется по уравнению Тафеля
(Δφа)Э=Х = а1 + b1lgia,
где а1 и b1 – константы.
2. Концентрационная поляризация – т.е. повышение концентрации собственных ионов металла непосредственно у поверхности электрода вследствие отставания процесса диффузии ионов металла в глубину раствора. Смещение потенциала по этой причине можно представить уравнением:
(Δφа)КОНЦ
=
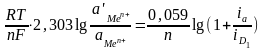
где
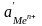 – активность ионов металла у поверхности
электрода;
– активность ионов металла у поверхности
электрода;
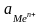 – активность
ионов металла в объеме раствора;
– активность
ионов металла в объеме раствора;
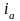 – плотность
анодного тока;
– плотность
анодного тока;
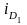 –
предельная
катодная плотность тока для данного
электролита.
–
предельная
катодная плотность тока для данного
электролита.
Поляризация анода, вызываемая этими двумя причинами, достигает небольших величин (участок (φМе)обрАВС на анодной поляризационной кривой, рисунок 9.2.).
3. Анодная пассивность заключается в образовании пассивных пленок на поверхности металла и вызывает резкое торможение анодного процесса. Потенциал анода при этом сильно смещается в положительную сторону (участок ВЕ на рисунке 9.2.), а величина тока скачкообразно падает до значений, достаточных для протекания нового анодного процесса (чаще всего выделения кислорода).
Рассмотренное выше позволяет заключить, что при активной коррозии, если нет явления пассивности, анодный процесс протекает без заметного торможения.
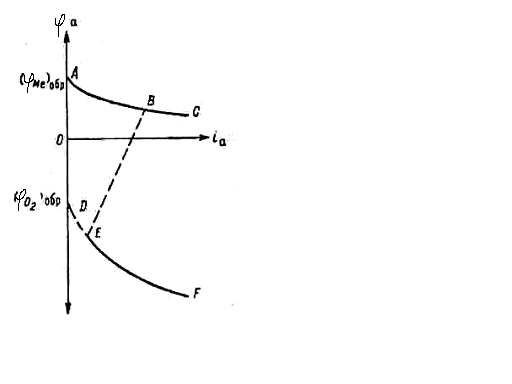
Рисунок 9.2. Анодная поляризационная кривая
Процессы, уменьшающие анодную поляризацию, называются деполяризационными процессами (например, перемешивание), а вещества, их осуществляющие – анодными деполяризаторами (NH3, CN–, Cl–).
Катодная поляризация
Эта поляризация обусловлена двумя причинами:
1. Электрохимическая поляризация катода – торможение электродного процесса за счет трудности протекания реакции соединения деполяризатора с электронами:
D + ne → [Dne]
Эта поляризация называется перенапряжением реакции катодной деполяризации и обозначается (ΔφК)Э=Х.
2. Концентрационная поляризация (ΔφК)КОНЦ – торможение катодного процесса вследствие недостаточной скорости подвода или отвода начальных или конечных продуктов реакции на катоде.
Возможные основные виды катодной деполяризации были рассмотрены выше.
2. Тестік тапсырмалар барлық теориялық сұрақтарды қамтиды.
3. Есептің түрлері:
Электрохимиялық процестердің жүру жағдайы
Электрохимиялық қаптау әдісі
Коррозиядан қорғаудағы гальваникалық жұптардың түзілуі
Коррозиялық көрсеткіштерді анықтау
