
- •Введение
- •1. История вопроса
- •2. Классификация методов хроматографии
- •3. Жидкостно-адсорбционная хроматография на колонке
- •3.1. Высокоэффективная жидкостная хроматография
- •3.2. Ионообменная хроматография
- •3.3. Тонкослойная хроматография
- •3.4. Хроматография на бумаге
- •3.5. Гельпроникающая (молекулярно-ситовая) хроматография
- •3.6. Газовая хроматография
- •4. Применение метода хроматографии к биологическим системам
- •4.1 Аффинная хроматография
- •4.2 Анализ аминокислот
- •4.3 Определение болезней животных методом газовой хроматографии
- •Заключение
- •Литература:
4. Применение метода хроматографии к биологическим системам
4.1 Аффинная хроматография
Относительно слабое обратимое взаимодействие между молекулами биполимеров и сорбентом может осуществляться за счет сил биологического сродства. Такие силы действуют, например, между ферментом и его субстратом или ингибитором, антигеном и антителом, гормоном и рецептором и т. д. Для осуществления фракционирования по биологическому сродству, т. е. методом аффинной хроматографии, один из «партнеров» такой пары химически закрепляют на матрице «биоаффинного» сорбента, а сорбцией и элюцией второго «партнера» управляют путем изменения условий биологического взаимодействия в результате введения в элюент солей, мочевины, детергентов, конкурирующих молекул или изменения его рН (см. рис. 4.1.1).
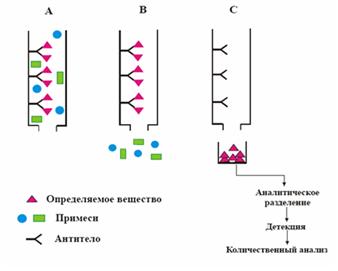 Рис.
4.1.1 Процесс афинной хроматографии
Рис.
4.1.1 Процесс афинной хроматографии
В большинстве случаев имеет место не хроматографический процесс фракционирования смеси веществ, а очистка одного из них путем избирательной сорбции, промывки и последующей десорбции. Впрочем, возможны варианты и истинной хроматографии, использующей явление аффинного взаимодействия. При этом фракционированию подвергается смесь близко родственных биологических макромолекул, различающихся по своему сродству к одному тому же аффинному сорбенту.
Иногда явление биологического сродства используется только в процессе элюции. В этом случае вещество связывается с поверхностью твердого сорбента за счет ионного взаимодействия или сил адсорбции, а элюцию осуществляют путем увеличения его сродства к элюенту, куда вводят биологически родственные (в указанном выше смысле) молекулы. Такой процесс было бы точнее называть аффинной элюцией. Имеются примеры, когда один из партнеров аффинной пары имеет не биологическое происхождение, а представляет собой, например, сложный краситель, пространственная конфигурация которого имитирует какую-либо биологическую структуру.
Аффинная хроматография отличается чрезвычайно высокой избирательностью, присущей биологическим взаимодействиям. Нередко одна хроматографическая процедура позволяет очистить нужный белок в тысячи раз. Это оправдывает затраты усилий на приготовление аффинного сорбента, что не всегда оказывается легкой задачей ввиду опасности утраты биологическими молекулами способности к специфическому взаимодействию в ходе их ковалентного присоединения к матрице.
Очистку белков и нуклеиновых кислот на аффинных сорбентах часто ведут не на колонках, а в объеме — методами центрифугирования и декантации.
Одной из разновидностью афинной хроматографии является металхелатная хроматография, основанная на образовании комплексов между нанесенным на сорбент ионом металла, например кадмия или никеля (никель-хелатная хроматография), и специфичеким линкером, обычно 6-10 остатков гистидина, химически связанным с целевым белком (Рис. 2). Особенно часто данный метод применяется при очистке генноинженерных белков, генетический код которых заклонирован в специально сконструированные плазмиды. В результате чего молекула белка экспрессируется с присоедененным полигистидиновым концом, за счет которого она специфичеки связывается ионом металла при нанесении на колонку, а примеси при этом не задерживаются, что позволяет достичь очень большой чистоты целевого продукта при минимальных затратах. Также, при необходимости возможно провести ренатурацию связанных с сорбентом белков (например обратным градиентом мочевины) после чего элюировать уже чистый биологически активный белок.
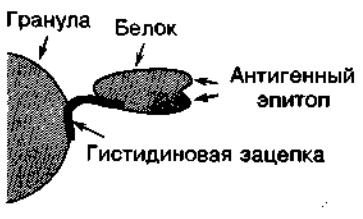
Рис.4.1.2. Прикрепление белка с гистидиновой зацепкой к грануле в аффинной колонке. Около 10 гистидиновых остатков присоединены к белку с помощью генетической инженерии, например, сочетанием сайт-специфического мутагенеза с полимеразной цепной реакцией (ПЦР) (см. Nolting, 1999b). Гистидиновые остатки прочно связываются с гранулами, сделанными из никель-хелатирующей смолы.
Также возможен несколько иной вариант аффинной хроматографии, в котором неправильно свернутый белок с помощью шаперонов сворачивается правильным образом и элюируется буферным раствором (Рис.4.1.3).
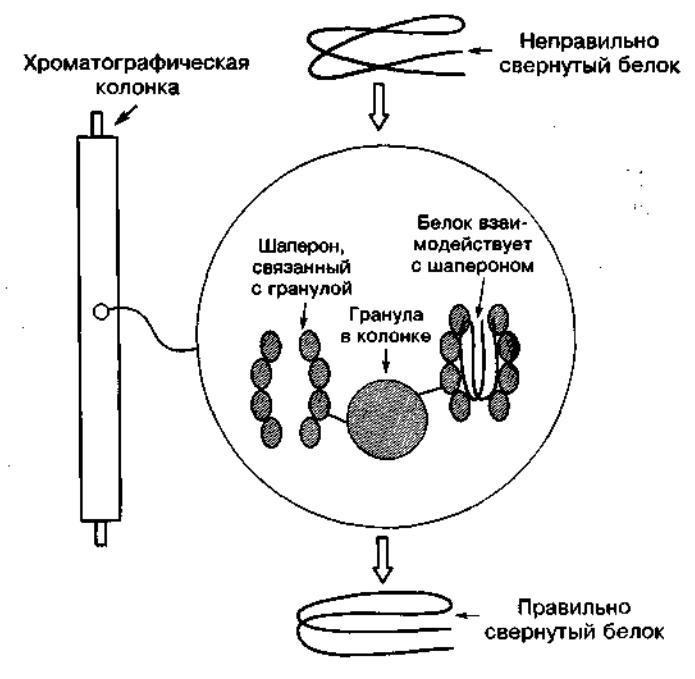
Рис. 4.1.3. Исправление свертывания дорогих, плохо сворачивающихся, белков: шапероны, называемые также шаперонинами, прикреплены к гранулам, и развернутый или неправильно свернутый белок пропускается сквозь колонку. Шаперон взаимодействует с образцом белка и катализирует его сворачивание в правильной конформации.
