
- •Номенклатура спиртов.
- •Химические свойства спиртов.
- •Физические свойства
- •Химические свойства
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •Способы получения
- •Применение фенолов
- •Химические свойства
- •3 Реакция полимеризации
- •Применение
- •Физические свойства
- •Характерные химические реакции
- •Карбоксильная группа (карбоксил) -соон — функциональная одновалентная группировка, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Строение карбоксильной группы
- •Примеры
Применение
Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Физические свойства
Низшие
карбоновые кислоты — жидкости с
острым запахом, хорошо растворимые
в воде. С повышением относительной
молекулярной массы растворимость кислот
в воде и их плотность уменьшаются, а
температура кипения повышается.
Высшие кислоты, начиная
с пеларгоновой (н-нонановой)
СН3-(СН2)7-СООН, —
твердые вещества, без запаха, нерастворимые
в воде. Низшие карбоновые кислоты в
безводном виде и в виде концентрированных
растворов раздражают кожу и вызывают
ожоги, особенно муравьиная
кислота и
уксусная кислота.
На физических
свойствах карбоновых кислот сказывается
значительная степень ассоциации
вследствие образования водородных
связей.
Кислоты в отличие от спиртов, образуют
более прочные водородные связи, вследствие
того что связи ![]() в
них в большей степени поляризованы по
типу
в
них в большей степени поляризованы по
типу ![]() Кроме
того, у карбоновых кислот имеется
возможность образования водородных
связей с кислородом карбонильного диполя,
обладающим значительной
электроотрицательностью, а не только
с кислородом другой гидроксильной
группы. Действительно, в твердом и жидком
состояниях карбоновые кислоты существуют
в основном в виде циклических димеров.
Кроме
того, у карбоновых кислот имеется
возможность образования водородных
связей с кислородом карбонильного диполя,
обладающим значительной
электроотрицательностью, а не только
с кислородом другой гидроксильной
группы. Действительно, в твердом и жидком
состояниях карбоновые кислоты существуют
в основном в виде циклических димеров.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот: 1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:
![]()
![]()
![]()
2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
![]()
![]()
3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
![]()
4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
![]()
5.
Под действием ![]() карбоновые
кислоты превращаются в
соответствующие хлорангидриды:
карбоновые
кислоты превращаются в
соответствующие хлорангидриды:
![]()
Карбоксильная группа (карбоксил) -соон — функциональная одновалентная группировка, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Строение карбоксильной группы
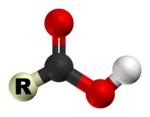
Карбоксильная группа сочетает в себе две функциональные группы — карбонил =CO и гидроксил -OH, взаимно влияющие друг на друга.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О-Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH = R-COO− + H+
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Взаимное влияние карбоновых кислот и углеводородного радикала
Муравьиная кислота НСООН является более сильной, чем уксусная кислота СН3СООН. Это объясняется влиянием метильного радикала. Легкость разрыва связи О-Н в карбоновых кислотах объясняется смещением электронной плотности к атому кислорода карбонильной группы. В молекуле уксусной кислоты карбоксильная группа связана с метильным радикалом, а в молекуле муравьиной кислоты - с атомом водорода. В молекуле уксусной кислоты происходит смещение электронной плотности от атомов водорода в метильном радикале к атому углерода карбоксильной группы (на рисунке показано стрелками).
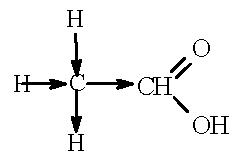
В результате смещение электронов от атома водорода гидроксильной группы уменьшается, связь О-Н становится менее полярной и разрывается труднее. Поэтому уксусная кислота более слабая, чем муравьиная, за счет влияния метального радикала.
Карбоксильная группа также оказывает влияние на углеводородный радикал. Например, замещение атомов водорода у ближайшего к карбоксильной группе атома углерода на атомы галогена происходит легче, чем в углеводородах.
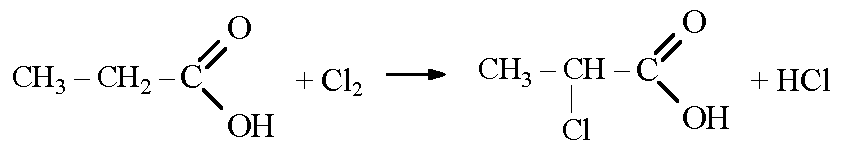
Предельные: 1 П-связь
Не предельные: 2 и 3 п-связи
Особенности муравьиной кислоты: 1) первый представитель гомологического ряда предельных кислот; 2) содержится в едких выделениях муравьев, в крапиве, хвое ели; 3) это самая сильная кислота в ряду одноосновных карбоновых кислот.
Муравьиная кислота имеет и другие особенности: 1) в молекуле кислоты легко можно заметить не только карбоксильную группу, но и альдегидную; 2) муравьиная кислота наряду с типичными свойствами кислот проявляет свойства альдегидов. Например, она легко окисляется аммиачным раствором оксида серебра (I).
Применение и получение муравьиной кислоты: а) муравьиная кислота применяется в технике в качестве восстановителя; б) реакцией кислоты со спиртами получают сложные эфиры, которые находят применение в качестве растворителей и душистых веществ.
Особенности уксусной кислоты: часто встречается в растениях, выделениях животных, образуется при окислении органических веществ.
Применение и получение уксусной кислоты. Из всех карбоновых кислот уксусная кислота имеет наиболее широкое применение. Используется водный раствор уксусной кислоты – уксус – в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.
