
- •Номенклатура спиртов.
- •Химические свойства спиртов.
- •Физические свойства
- •Химические свойства
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •Способы получения
- •Применение фенолов
- •Химические свойства
- •3 Реакция полимеризации
- •Применение
- •Физические свойства
- •Характерные химические реакции
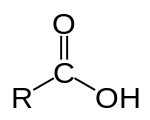
- •Карбоксильная группа (карбоксил) -соон — функциональная одновалентная группировка, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Строение карбоксильной группы
- •Примеры
3 Реакция полимеризации
Формальдегид образует параформальдегид (n=8-100) при длительном стоянии или испарении.
![]()
При циклизации образуются триоксан (n = 3) и тетраоксиметилен (n = 4).
4 Реакция поликонденсации При нагревании альдегида с фенолом в кислой или щелочной среде образуются фенолформальдегидные смолы.
НОМЕНКЛАТУРА АЛЬДЕГИДОВ. Замещающие и функциональные группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Для некоторых альдегидов часто используют тривиальные (упрощенные) названия, сложившиеся исторически, например, формальдегид Н2С=О, ацетальдегид Н3СС(Н)=О, кротоновый альдегид СН3СН=CHC(H)=O.
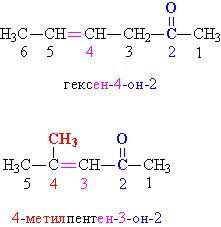
В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе (рис. 2).
Физические свойства:
Так как альдегиды и кетоны полярные соединения, они имеют более высокие температуры кипения, чем неполярные соединения сравнимого молекулярного веса, но ниже, чем у спиртов, что указывает на отсутствие у оксосоединений существенной молекулярной ассоциации. Низшие оксосоединения заметно растворимы в воде, вероятно, вследствие образования водород-ных связей; обладают резким запахом. С увеличением размера молекул (начиная с С 5 ) растворимость резко уменьшается; высшие альдегиды и кетоны обладают приятным запахом
АЛЬДЕГИДЫ И КЕТОНЫ Химия оксосоединений определяется наличием карбонильной группы. ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ: 1. Карбонильная группа содержит двойную углерод кислородную связь, которая сильно поляризована 2. Плоское строение оксогруппы, отсюда доступность группы для атаки сверху и снизу. С О δ + δ –
Кроме того карбонильная группа увеличивает кислотность атомов водорода, связанных с -углеродным атомом за счёт оттягивания электронной плотности: – С – С = О δ+ ..
Только муравьиный и уксусный альдегиды хорошо растворимы в воде.
Кетоны — это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1–CO–R2.
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых отношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой.
71
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислыесвойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
о международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание "овая" и слово "кислота". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота. По рациональной номенклатуре к названию углеводорода добавляют окончание "карбоновая" и слово "кислота", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет-бутилкарбоновая кислота. Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Формула |
Название по ИЮПАК |
Тривиальное название |
НСООН |
метановая кислота |
муравьиная кислота |
СН3-СООН |
этановая кислота |
уксусная кислота |
СН3-СН2-СООН |
пропановая кислота |
пропионовая кислота |
СН3-(СН2)2-СООН |
бутановая кислота |
масляная кислота |
