- •Номенклатура спиртов.
- •Химические свойства спиртов.
- •Физические свойства
- •Химические свойства
- •1. Реакции с участием гидроксильной группы
- •2. Реакции с участием бензольного кольца
- •Способы получения
- •Применение фенолов
- •Химические свойства
- •3 Реакция полимеризации
- •Применение
- •Физические свойства
- •Характерные химические реакции
- •Карбоксильная группа (карбоксил) -соон — функциональная одновалентная группировка, входящая в состав карбоновых кислот и определяющая их кислотные свойства. Строение карбоксильной группы
- •Примеры
67
Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производныеводы (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
— первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол).
одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
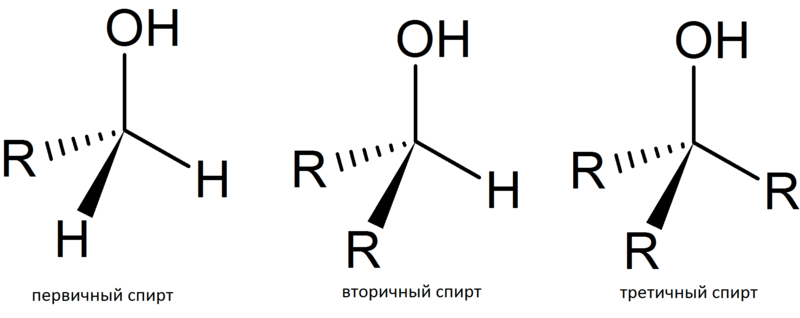
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).

в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).

СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите

Номенклатура спиртов.
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):

Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na ® 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O ® C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–CH2–CH2–OH + 2NaOH ® NaO–CH2–CH2–ONa + 2H2O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот .
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны

Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Многоатомные спирты глицерин = 1,26 г/см3.) 1,11 г/см3; tкип (глицерин) = 290°С, — бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо — в органических растворителях; имеют высокие температуры кипения. Например, tкип этиленгликоля 198°С, плотность (
Особенности строения многоатомных спиртов:
1) содержат в молекуле несколько гидроксильных групп, соединенных с углеводородным радикалом;
2) если в молекуле углеводорода заменены гидроксильными группами два атома водорода, то это двухатомный спирт;
3) простейшим представителем таких спиртов является этиленгликоль (этандиол-1,2):
СН2(ОН) – СН2(ОН);
4) во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода;
5) для получения спирта, в котором хотя бы две гидроксильные группы находились бы при одном атоме углерода, проводилось много опытов, но спирт получить не удалось: такое соединение оказывается неустойчивым.
Наиболее употребительный многоатомный спирт – глицерин, он получается расщеплением жиров, а в настоящее время все больше синтетическим способом из пропилена, который образуется при крекинге нефтепродуктов.
Этиленгликоль - типичный представитель многоатомных спиртов. Его химическая формула CH2OH - CH2OH. - двухатомный спирт.
68
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы.
Простые эфиры — подвижные легкокипящие жидкости, малорастворимые в воде, очень легко воспламеняющиеся. Проявляют слабоосновные свойства (присоединяют протон по атому O)
При замещении водорода спиртов или фенолов на углеводородный радикал получают простые эфиры, например С2Н5ОС6Н5 или С6Н5ОС6Н5.
69
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца. По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.