
- •Теория химической кинетики. Понятия.
- •Кинетика сложных цепных реакций.
- •Кинетика гетерогенных реакций.
- •Кинетика гомогенных реакций
- •Гомогенный катализ. Ферментативный катализ.
- •Трехкомпонентные системы.
- •V1 до объема v2 при различных условиях.
- •Основной закон фазового равновесия.
- •Равновесие чистого вещества в 2х фазах однокомпонентной системы.
- •Трехкомпонентные системы.
Трехкомпонентные системы.
На практике наряду с двухкомпонентными системами гораздо чаще приходится иметь дело с системами, составленными из трех и более компонентов. Уравнение состояния трехкомпонентных систем связывает между собой пять параметров и имеет следующий вид:
 .
(6.12) Из (6.12) следует, что диаграмма
состояния трехкомпонентной системы
не может быть изображена на плоскости.
Полагая, что Р = const и С1
+ С2
+ С3
= 1, если способ выражения состава сплавов
мольные доли, трехкомпонентную диаграмму
можно построить в трехмерном пространстве.
Составы трехкомпонентных сплавов
принято изображать на плоскости с
помощью концентрационного треугольника.
В вершинах треугольника располагаются
чистые компоненты А, В и С, а три его
стороны отражают составы двойных
сплавов. Ось, перпендикулярная плоскости
концентрационнго треугольника -
температурная ось. Свойства
концентрационного треугольника.
Первое
свойство.
Если из какой-то точки М, лежащей в
плоскости треугольника опустить три
перпендикуляра на стороны, то:
.
(6.12) Из (6.12) следует, что диаграмма
состояния трехкомпонентной системы
не может быть изображена на плоскости.
Полагая, что Р = const и С1
+ С2
+ С3
= 1, если способ выражения состава сплавов
мольные доли, трехкомпонентную диаграмму
можно построить в трехмерном пространстве.
Составы трехкомпонентных сплавов
принято изображать на плоскости с
помощью концентрационного треугольника.
В вершинах треугольника располагаются
чистые компоненты А, В и С, а три его
стороны отражают составы двойных
сплавов. Ось, перпендикулярная плоскости
концентрационнго треугольника -
температурная ось. Свойства
концентрационного треугольника.
Первое
свойство.
Если из какой-то точки М, лежащей в
плоскости треугольника опустить три
перпендикуляра на стороны, то:
МА + МВ + МС = const = BD, где BD - высота концентрационного треугольника (рис. 6.9, а).

Если BD принять за 100%, то каждый из перпендикуляров - концентрация каждого из компонентов в сплаве: Ма = % А; Мb = % B; Mc = % C. Второе свойство. Если через точку М, лежащей в плоскости треугольника, провести три параллельные сторонам треугольника прямые, то сумма отрезков Аb, Bc и Са, отсекаемых этими прямыми на сторонах треугольника - величина постоянная и равная стороне треугольника:
Аb + Вс + Са = const = АВ. Если АВ = % В, Вс = % С и Са = % А, то состав трехкомпонентного сплава определен. Таким образом, зная свойства равностороннего треугольника, по положению фигуративной точки можно оценить состав трехкомпонентного сплава или, зная его состав, можно найти положение фигуративной точки в плоскости концентрационного треугольника. Как и для двухкомпонентных систем, сложность диаграмм состояния трехкомпонентных систем зависит от взаимной растворимости компонентов и от возможности образования между ними химических соединений. Наиболее простой является диаграмма состояния трехкомпонентной системы с неограниченной растворимостью компонентов в жидком и твердом состояниях (рис. 6.10).
Д ля
диаграммы на рис. 6.10 ТS
(B)
> ТS
(A)
> ТS
(С)
т. А’, B’ и C’ - температуры плавления
чистых компонентов. Грани призмы -
двойные системы с неограниченной
растворимостью компонентов в твердом
и жидком состояниях. Через три ликвидуса
проходит поверхность ликвидуса. Выше
поверхности ликвидуса находится объем
жидких растворов (L). Через три солидуса
проходит поверхность солидуса. Ниже
поверхности солидуса располагается
объем твердых растворов (
ля
диаграммы на рис. 6.10 ТS
(B)
> ТS
(A)
> ТS
(С)
т. А’, B’ и C’ - температуры плавления
чистых компонентов. Грани призмы -
двойные системы с неограниченной
растворимостью компонентов в твердом
и жидком состояниях. Через три ликвидуса
проходит поверхность ликвидуса. Выше
поверхности ликвидуса находится объем
жидких растворов (L). Через три солидуса
проходит поверхность солидуса. Ниже
поверхности солидуса располагается
объем твердых растворов (
 ).
Объем пространства между поверхностями
ликвидуса и солидуса занят равновесной
двухфазной системой из жидких и твердых
растворов (L +
).
Интервал между поверхностью ликвидуса
и солидуса - интервал кристаллизации
(плавления) сплавов трехкомпонентной
системы. Сплав состава т. М (рис. 6.10) при
Т > Т1
находится в состоянии ненасыщенного
жидкого раствора. Кристаллизация сплава
начинается при Т1,
лежащей на поверхности ликвидуса.
Состав первых кристаллов
- твердого раствора соответствует
проекции точки 1’ на плоскость
концентрационного треугольника. При
дальнейшем понижении температуры от
Т1
до Т2
жидкость постепенно принимает состав
т. 2’ и исчезает, а кристаллы
- твердого раствора - т. 2. Поэтому процесс
кристаллизации сплава изображается
уравнением вида:
).
Объем пространства между поверхностями
ликвидуса и солидуса занят равновесной
двухфазной системой из жидких и твердых
растворов (L +
).
Интервал между поверхностью ликвидуса
и солидуса - интервал кристаллизации
(плавления) сплавов трехкомпонентной
системы. Сплав состава т. М (рис. 6.10) при
Т > Т1
находится в состоянии ненасыщенного
жидкого раствора. Кристаллизация сплава
начинается при Т1,
лежащей на поверхности ликвидуса.
Состав первых кристаллов
- твердого раствора соответствует
проекции точки 1’ на плоскость
концентрационного треугольника. При
дальнейшем понижении температуры от
Т1
до Т2
жидкость постепенно принимает состав
т. 2’ и исчезает, а кристаллы
- твердого раствора - т. 2. Поэтому процесс
кристаллизации сплава изображается
уравнением вида:
 .
(6.10) Ниже температуры Т2
происходит охлаждение кристаллов
твердого раствора
.
При работе с диаграммами состояния
трехкомпонентных систем удобно
пользоваться их разрезами - поли- и
изотермическими. Изотермические разрезы
характеризуют фазовые равновесия в
тройных сплавах, а по политермическим
разрезам устанавливают температуры
начала и конца кристаллизации сплавов
и т.д.
.
(6.10) Ниже температуры Т2
происходит охлаждение кристаллов
твердого раствора
.
При работе с диаграммами состояния
трехкомпонентных систем удобно
пользоваться их разрезами - поли- и
изотермическими. Изотермические разрезы
характеризуют фазовые равновесия в
тройных сплавах, а по политермическим
разрезам устанавливают температуры
начала и конца кристаллизации сплавов
и т.д.
Растворение твердого вещества – происходит разрушение кристаллической решетки, это связано с затратой энергии. Одновременно с растворением происходит процесс сольватации (гидратации – когда в воде). Таким образом теплота складывается из двух слагаемых: (Qразрушения)+(Qсольватации)=Qраств. Знак теплового эффекта зависит от того, какой из слагаемых больше по абсолютной величине. Если вещество обладает относительно прочной кристаллической решеткой, то в процессе растворения, тепла для разрушения кристаллической решетки будет поглощаться больше, чем выделяться при сольватации. В результате чего раствор будет охлаждаться.
Теплоемкость.
Теплоемкость изменяется с изменением температуры, причем величина этого изменения различна в различных температурных интервалах. Качественно характер изменения С = f (Т) для большинства металлов, не испытывающих фазовых превращений в твердом состоянии представлен на рис. 2.1.


Рис. 2.1. Характер изменения теплоемкости с температурой.
Для
металлов в твердом состоянии в области
низких температур (T
< Tкомн.)
характерна зависимость отвечающая
уравнению кубической параболы:
 .
С понижением температуры теплоемкость
быстро уменьшается и при
.
С понижением температуры теплоемкость
быстро уменьшается и при
 стремится принять нулевое значение. В
области комнатных температур (Ткомн.)
теплоемкость определяется из закона
Дюлонга - Пти. Дальнейшее повышение
температуры плавления (ТS)
вызывает непрерывное увеличение
теплоемкости. Этот температурный
участок представляет наибольший
практический интерес. Для него зависимость
С = f
(Т) выражается с помощью эмпирических
соотношений, имеющих вид степенных
рядов:
стремится принять нулевое значение. В
области комнатных температур (Ткомн.)
теплоемкость определяется из закона
Дюлонга - Пти. Дальнейшее повышение
температуры плавления (ТS)
вызывает непрерывное увеличение
теплоемкости. Этот температурный
участок представляет наибольший
практический интерес. Для него зависимость
С = f
(Т) выражается с помощью эмпирических
соотношений, имеющих вид степенных
рядов:
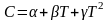 ,
(2.18)
,
(2.18)
 ,
(2.19)
Теплоемкость для жидкого состояния
(ТS
- TE)
характеризуется, как правило, меньшей
величиной, чем для твердого состояния,
причем не изменяющейся вплоть до
температуры кипения (ТЕ).
,
(2.19)
Теплоемкость для жидкого состояния
(ТS
- TE)
характеризуется, как правило, меньшей
величиной, чем для твердого состояния,
причем не изменяющейся вплоть до
температуры кипения (ТЕ).
Работа идеальных процессов.
Из определения функции "работа" следует, что она не является функцией состояния и ее величина зависит от того, в каких условиях она совершается. Изобарический процесс (p = const).
 ,
,
где
 ,
а
,
а
 .Тогда
.Тогда
 ,
(1.17)
,
(1.17)
т. е. работа совершается при увеличении температуры системы. Изотермический процесс (Т = const).
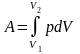 ,
где
,
где
 ,
тогда
,
тогда
 (1.18)Изобарно-изотермический
процесс (Р, Т = const).
(1.18)Изобарно-изотермический
процесс (Р, Т = const).
 ,
,
т. е. в системе с неизменным количеством вещества такой процесс невозможен. Если n1 - количество вещества в системе до реакции, а n2 - количество вещества в системе после реакции, то
 ,
(1.19)
,
(1.19)
где
 -
изменение количества вещества в системе
за счет химической реакции. Адиабатический
процесс.
Адиабатический процесс характеризуется
отсутствием энергообмена в форме
теплоты с окружающей средой, что
определяется математически в виде
условия
-
изменение количества вещества в системе
за счет химической реакции. Адиабатический
процесс.
Адиабатический процесс характеризуется
отсутствием энергообмена в форме
теплоты с окружающей средой, что
определяется математически в виде
условия
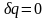 .
В этом случае уравнение первого начала
принимает вид:
.
В этом случае уравнение первого начала
принимает вид:
 ,
(1.20) где
,
(1.20) где .
(1.21)
.
(1.21)
Тогда
величина работы: ,
(1.21) где СV
- изохорическая теплоемкость системы,
которая тем больше, чем сложнее устройство
,
(1.21) где СV
- изохорическая теплоемкость системы,
которая тем больше, чем сложнее устройство
молекул.

Рис. 1.1. Графическое изображение работы
расширения идеального газа от объема
