
- •NaCl Natrii chloridum.
- •KCl Kalii chloridum
- •NaBr Natrii bromidum.
- •KBr Kalii bromidum
- •NaI Natrii iodidum
- •Ki Kalii iodidum
- •Natrii thiosulfas.
- •Natrii hydrocarbonas.
- •Natrii tеtraborаs seu Borax (бура)
- •Protorgolum seu Argentum proteinicum
- •Collargolum seu Argentum colloidale
- •Solutio Formaldehydi seu Formalinum
- •Hexamethylentetraminum seu Urotropinum seu Methenaminum
- •Глюкоза
- •Димедрол
- •Calcii gluconas
- •2. Метод нейтрализации.
- •Natrii citras pro injectionibus
- •Acidum aminocapronicum
- •Аdrenalini hydrotatras
- •Ephedrini hydrochloridum
- •Резорцин – Resorcinum
- •Acidum benzoicum
- •Acidum salicylicum
- •Natrii benzoas
- •Салицилат натрия – Natrii salicylas
- •Acidum acetylsalicylicum (Aspirinum)
- •Стрептоцид – Streptocidum
- •Норсульфазол –Norsulfazolum seu Sulfathiazolum
- •Phthalazolum-фталазол
- •Anaesthesinum. Aethyliiaminobenzoas
- •Natrii para-aminosalicylas
- •Furacilinum
- •Antipyrinum
- •Analgini.
- •Dibazolum
Solutio Formaldehydi seu Formalinum
Получение:
Метиловый спирт насыщают кислородом и пропускают через раскаленную медную проволоку (медь-катализатор).
![]()
O2+Cu=>2CuO
CH3-ОН+CuO=>CH2O+Cu+H2O
![]()
Для предотвращения разложения формальдегида к раствору добавляют 1% метилового спирта. При хранении раствора при температуре меньше 90С образуется белый осадок параформа, который не обладает действием формальдегида – ОБРАТНАЯ РЕАКЦИЯ НЕВОЗМОЖНА!
Свойства. Прозрачная бесцветная жидкость со своеобразным резким запвахом. Смешивается с водой и спиртом.
Подлинность:
1)Реакция “серебряного зеркала”.
К AgNO3 добавляют раствор аммиака до растворения образовавшегося осадка к полученному раствору прибавляют препарат и нагревают. По стенкам пробирки образуется металлическое серебро.
2AgNO3+2NH4OH=>Ag2O↓+2NH4NO3
Ag2O↓+4NH4OH=>2[Ag(NH3)2]OH+3H2O
![]()
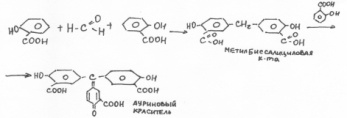
2)Получение ауринового красителя.
В выпарительную чашку помещают препарат, кристаллическую салициловую кислоту и концентрированную H2SO4.Постепенно появляется малиновое окрашивание.
Количественное определение:
Формальдегид может окисляться йодом.
![]()
Но реакция обратима, поэтому количественное определение- Метод йодометрии обратное титрование в щелочной среде.
ТНП помещают в банку с притертой пробкой (I2-летуч), добавляют избыток титрованного раствора йода и раствор щелочи и оставляют в темном месте на 10-15 мин.
I2+2NaOH=>NaI+NaIO+H2O
![]()
Затем раствор подкисляю серной кислотой, выделившийся йод оттитровывают Na2S2O3 до светло-желтой окраски, затем добавляют крахмал и продолжают титровать до обесцвечивания.
NaIO+NaI+H2SO4=>I2+Na2SO4+H2O
I2+2Na2S2O3=>Na2S4O6+2NaI
Применение.Наружно как антисептическое средство для дезинфекции рук, кожи, инструментов. используют для консервации биологических материалов.
Хранение. В хорошо закрытых банках при температуре не ниже 90С(образуется параформ) Для предохранения полимеризации и реакции дисмутации к раствору добавляют 1% метилового спирта.
Hexamethylentetraminum seu Urotropinum seu Methenaminum
![]()
Получение
Получают при формальдегида и аммиачной воды. Реакцию ведут при t=40 – 50. После окончания реакции среда должна быть оставаться щелочной и ощущаться запах аммиака. К раствору добавляют активированный уголь, фильтруют , выпаривают фильтрат в акуме до массы. После охлаждения кристаллизуется препарат. Его промывают , сушат и очищают перекристаллизации из спирта.
![]()
(CH2)6 N4 * 3AgNO3
(CH2)6 N4 * CaCI2
Может образовывать соли с минеральными кислотами
(CH2)6 N4 * HCI
Подлинность
1. Кислотный гидролиз и док-во выделяющихся продукт. реакции.
Препарат растворяют в воде добавляют H2SO4 и нагревают, ощущается характерный запах формальдегида, при добавления избытка щелочи ощущается запах аммиака.
![]()
![]()
2. Получение ауринового красителя.
Препарат помещают в выпарительную чашку, прибавляют концент. H2SO4 и нагревают , ощущается запах формальдегида и постепенно появляется малиновое окрашивание
а)![]()
б)![]()
Количественное определение
По ГФ.
1. Метод нейтрализации. Обратное титрование
ТНП растворяют в воде и прибавляют избыток титровоного раствора H2SO4. Нагревают на водяной бане , затем раствор охлаждают и титруют раствором щелочи с 0,1 моль/л до желтого окрашивания. Индикатор м/ф
H2SO4 + 2NaOH = NaSO4 + 2H2O
2. Метод нейтрализации, прямое титрование. Менее точен, но используют в аптеке.
ТНП помещают в колбу титрования, добавляют смешанный индикатор ( м /ф + метиловый синий в соот. 2:1) и титруют раствором HCI концентрацией 0,1 моль/л до перехода зеленой окраски в фиолетовый.
(CH2)6 N4 + HCI = (CH2)6 N4 + HCI
3. Если растворы с концентрацией более5% , то определяют методом рефрактометрии.
