
- •1. Основні поняття і визначення
- •1.1 Термічні параметри стану і зв‘язок між ними
- •1.2 Газові суміші
- •1.3 Калоричні параметри стану термодинамічної системи
- •2. Теплота і робота
- •2.1 Аналітичні вирази для роботи і теплоти процесу. Теплоємність.
- •Теплота. Теорія тепло ряду і молекулярно – кінетична теорія теплоти
- •Теплота і робота в залежності від характеру термодинамічного процесу
2. Теплота і робота
Найважливішими поняттями технічної термодинаміки є теплота і робота. Вище було сказано, енергетична взаємодія термодинамічної системи з навколишнім середовищем відбувається двома шляхами: передачею тепла і створення механічної енергії.
Робота є мірою енергії, переданої механічним способом, тобто направлене дією одного тіла на інше.
Теплота є мірою енергії, яка передана за рахунок наявності різниці температур. Обмін енергією в цьому випадку проходить шляхом безпосереднього контакту тіл, які мають різну температуру, або випромінюванням. Енергія передається в формі молекулярно хаотичного руху.
Робота і теплота є енергетичними характеристиками термодинамічного процесу, а їх величина залежить від типу процесу. Поза процесом поняття робота і теплота не мають сенсу.
2.1 Аналітичні вирази для роботи і теплоти процесу. Теплоємність.
Рис.5
–
Робота
у термо-димічному процесі
Розглянемо газ, який знаходиться в циліндрі, як показано на рис.1. Приймемо, що газ займає об‘єм V і його тиск Р. Якщо площу поршня прийняти S, тоді сила, що діє на поршень буде F=PS. Допустимо газ діючи на поршень, переміщає його на малу відстань dx. Оскільки робота – це добуток сили на переміщення dL = PSdx, ΔV = dxS – елементарний об‘єм, тоді dL = PdV. На рис. 5 зображений графік в P-V координатах, який називається робочою діаграмою. Початковий стан газу зображений точкою А, а кінцевий стан – точкою В. Процес іде по шляху АхВ. Робота вираховується з рівняння :
 і дорівнює площі під кривою.
і дорівнює площі під кривою.
Теплота. Теорія тепло ряду і молекулярно – кінетична теорія теплоти
Існує два способи знаходження кількості тепла. Перший спосіб пов‘язаний з використанням поняття ентропії. Теплота визначається з рівняння dq=TdS (dS=dq/T). Вираз для визначення роботи подібний до виразу визначення теплоти.
Для кінцевого процесу, в
якому ентропія змінюється від S1
до S2
загальний вираз для кількості теплоти
приймає вигляд
 .
В загальному випадку графічно ця
залежність може бути зображена в T-S
координатах кривою 1-2 (рис.6).
.
В загальному випадку графічно ця
залежність може бути зображена в T-S
координатах кривою 1-2 (рис.6).
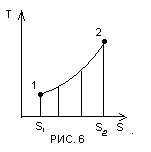
Подібно до того як в P-V діаграмі площа, обмежена кривою процесу і віссю абсцис, зображає роботу, в Т-S – діаграмі площа, обмежена кривою процесу і віссю абсцис, є кількість теплоти, що приймає участь в процесі
= площі 1,2,S2,S1,1.
Інший спосіб знаходження кількості теплоти, яку поглинає або виділяє тіло (термодинамічна система) в якому – небудь процесі, пов‘язане з поняттям теплоємності. Q~mΔt Q=cmΔt
В загальному випадку підведення або відведення теплоти від тіла призводить до зміни його температури.
Відношення кількості теплоти qx, до відповідного рівня зміни температури Δt=t2-t1, називається теплоємністю тіла в термодинамічному процесі.
![]() - середня
теплоємність
- середня
теплоємність
Границя, до якої прямує середня теплоємність при Δt→0 називається істиною теплоємністю для заданого процесу Х.

Теплоємність для газів залежить від термодинамічного процесу і поділяється на теплоємність ізобарну Ср і ізохорну Cv. Зв‘язок між ними встановлений відомим рівнянням Майєра Сp-Cv=R, де R – питома газова стала.
Питома теплоємність – це теплоємність одиниці кількості речовини :відповідно є мольна, масова і об‘ємна теплоємності.
![]() ;
;
![]()
Для мольної теплоємності
рівняння Майєра:
![]()
![]() - універсальна газова стала.
- універсальна газова стала.
Відношення теплоємностей Ср і Сv називається показником адіабати
![]()
![]()
Згідно класично – кінетичної теорії теплоємність залежить тільки від атомності газів і не враховує залежності теплоємності газів від температури. Ці дані приведені в таблиці:
Атомність газу |
Мольна теплоємність кДж/(мольК) |
k=Cp/Cv |
|
μCv |
μCp |
||
Одноатомний |
12.5 |
20.8 |
1.67 |
Двохатомний |
20.8 |
29.1 |
1.40 |
Багатоатомний |
25.0 |
33.3 |
1.33 |
Для реальних газів теплоємність визначається з таблиць довідників.
В наступній таблиці приведена класифікація різних видів теплоємності:
Теплоємність |
Масова кДж/(кгК) |
Об‘ємна кДж/(м³К) |
Мольна кДж/(мольК) |
|||
істина |
середня |
істина |
середня |
істина |
середня |
|
Ізохорна |
Сv |
Cvm |
C‘v |
C‘vm |
μCv |
μCvm |
Ізобарна |
Cp |
Cpm |
C‘p |
C‘pm |
μCp |
μCpm |
