
- •1. Основні поняття і визначення
- •1.1 Термічні параметри стану і зв‘язок між ними
- •1.2 Газові суміші
- •1.3 Калоричні параметри стану термодинамічної системи
- •2. Теплота і робота
- •2.1 Аналітичні вирази для роботи і теплоти процесу. Теплоємність.
- •Теплота. Теорія тепло ряду і молекулярно – кінетична теорія теплоти
- •Теплота і робота в залежності від характеру термодинамічного процесу
1.2 Газові суміші
На практиці доводиться мати справу не з чистими газами, а з їх сумішами. Такими сумішами є продукти згоряння палива та природні гази. Основним законом, який описує поведінку газових сумішей є закон Дальтона, згідно з яким загальний тиск суміші газів дорівнює сумі парціальних тисків його компонент:
![]()
тут Р- загальний тиск газової суміші, Р1,Р2..- парціальні тиски компонентів газової суміші.
Парціальним тиском компонента газової суміші називається той тиск, який би створював даний компонент при температурі газової суміші, якби він займав той об‘єм який займає газова суміш.
Парціальним об‘ємом називається той об‘єм, який займав би даний компонент при температурі і тиску газової суміші.
Газова суміш може бути задана масовими, об‘ємними і мольними частками .
Масовою часткою даного компонента суміші gi, називається відношення маси цього компонента mi до загальної маси суміші М
![]()
Сума масових часток газової
суміші дорівнює одиниці -
![]()
Об‘ємною часткою даного компонента суміші gi ,називається відношення об‘єму цього компонента νi до загального об‘єму суміші V:
![]()
Сума об‘ємних часток
компонентів газової суміші дорівнює
одиниці -
![]()
Мольною часткою даного компонента називається відношення маси цього компонента Ni до загального числа молей газової суміші N і дорівнює об‘ємній частці:
![]()
Сума мольних часток газової суміші також рівна одиниці. Співвідношення між масовими і об‘ємними частками газової суміші
![]() , або
, або
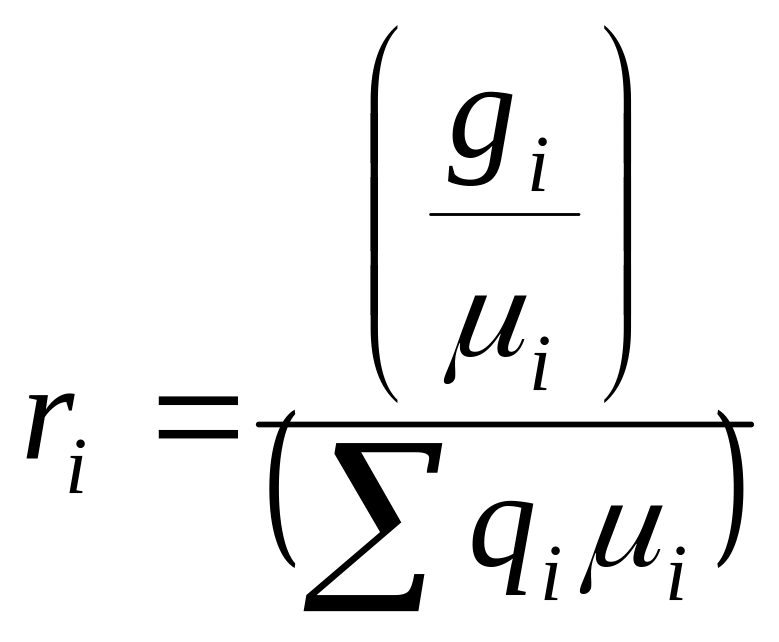
Молекулярна маса суміші, яка задана об‘ємними частками визначається за формулою:
![]() ,
,
де
![]() -
молярна маса і-го компонента газової
суміші ;
-
молярна маса і-го компонента газової
суміші ;
![]() -
об‘ємні частки компонентів газової
суміші.
-
об‘ємні частки компонентів газової
суміші.
Для знаходження питомої газової сталої можна скористатись формулами
![]() , або
, або

Парціальний тиск компонентів газової суміші, коли відомий загальний тиск можна знайти за формулою
![]()
1.3 Калоричні параметри стану термодинамічної системи
До калоричних параметрів стану відносяться : внутрішня енергія U, ентальпія H і ентропія S.
Внутрішня енергія
– енергія хаотичного (теплового) руху
молекул, яка залежить від параметрів
стану. Для ідеального газу внутрішня
енергія залежить тільки від абсолютної
температури
![]() .
.
Внутрішня енергія є однозначною функцією стану системи і є тому один із параметрів стану термодинамічної системи.
Зміна внутрішньої енергії не залежить від характеру процесу, а залежить від початкового і кінцевого стану термодинамічної системи (газу). Для замкнутого кругового процесу (циклу) зміна ΔU=0.
Ентальпія. Розглянемо повну енергію газу, який знаходиться під тиском Р, що утримує поршень навантажений силою G. В цьому випадку повна енергія Е
Рис.4-Термодинамічний
круговий процес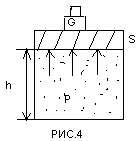
![]() ,
тобто
,
тобто
![]()
Величина РV, яка залежить від сил, що діють на поршень, називається пружною енергією тиску .
Ентальпія – це величина, яка описує стан газу, що знаходиться в середовищі з тиском Р і є повною енергією цього газу H=U+PV.
Ентальпія – це сума внутрішньої енергії газу і його пружної енергії, яка створена тиском на газ зі сторони навколишнього середовища. Ентальпія є функцією стану, параметром стану, її зміна не залежить від характеру процесу, а лише від початкового і кінцевого стану.
Ентропія
– це такий параметр стану, диференціал
якого дорівнює відношенню безкінечно
малої кількості теплоти dQ
в зворотному процесі до
абсолютної температури
![]() .
Ентропія характеризує якість теплоти.
.
Ентропія характеризує якість теплоти.
