
- •Основные понятия и определения химической кинетики
- •Скорость химической реакции
- •Кинетическое уравнение химического процесса и элементарной реакции. Константа скорости и энергия активации
- •Зависимость константы скорости реакции от температуры
- •Составление кинетических уравнений на основе схемы механизма химического процесса
- •Метод боденштейна-семенова
Раздел Химическая кинетика органических реакций Часть 1
Оглавление
Основные понятия и определения химической кинетики 1
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ 2
КИНЕТИЧЕСКОЕ УРАВНЕНИЕ ХИМИЧЕСКОГО ПРОЦЕССА И ЭЛЕМЕНТАРНОЙ РЕАКЦИИ. КОНСТАНТА СКОРОСТИ И ЭНЕРГИЯ АКТИВАЦИИ 5
Зависимость константы скорости реакции от температуры 7
СОСТАВЛЕНИЕ КИНЕТИЧЕСКИХ УРАВНЕНИЙ НА ОСНОВЕ СХЕМЫ МЕХАНИЗМА ХИМИЧЕСКОГО ПРОЦЕССА 13
МЕТОД БОДЕНШТЕЙНА-СЕМЕНОВА 14
Основные понятия и определения химической кинетики
Химическая кинетика – учение о скоростях и механизмах химических реакций.
Проведение кинетического анализа химического процесса связано с исследованием его кинетики, установлением количественной связи между скоростью реакции и концентрациями (парциальными давлениями) реагирующих веществ в зависимости от внешних факторов (температуры, давления, фазового состояния реакционной системы, катализатора, среды и др.), механизма и кинетики элементарных реакций с участием лабильных промежуточных частиц (возбужденных молекул, радикалов, ионов и др.).
Конечной целью кинетического исследования является составление кинетической модели процесса, которая представляет собой систему кинетических уравнений, описывающих изменение состояния реакционной системы при определенных термодинамических и кинетических параметрах (например, Р, V, Т, К, k, Е, коэффициенты адсорбции, Ci Pi и др.). Полученные сведения о кинетической модели служат основой при разработке оптимального режима химико-технологического процесса или в научных целях – установлению механизма реакции.
Кинетическое исследование может включать следующие основные этапы:
1. Критический анализ литературных источников по изучаемому или аналогичному химическому процессу с целью получения обоснованных сведений о продуктах реакций, включая лабильные частицы, возможных элементарных реакциях и их термодинамических и кинетических характеристиках, поведении катализаторов, влиянии продуктов и среды на отдельные реакции и химический процесс в целом и т. д.
2. Обоснование экспериментального исследования, включая такие аспекты, как выбор реакционного устройства, методики проведения опытов и анализа лабильных и стабильных продуктов.
3. Проведение эксперимента.
4. Формулировка кинетической схемы механизма химического процесса и составление на ее основе кинетических уравнений – кинетической модели.
5. Обработка экспериментальных данных по полученным кинетическим уравнениям. Необходимо заметить, что в ходе кинетического исследования могут появиться дополнительные, возможно, важные этапы, связанные с уточнением или дополнением, например, отдельных стадий реакций, природы промежуточных активных частиц и их реакционной способности и т. д.
При кинетическом исследовании химического процесса экспериментатор постоянно сталкивается с такими понятиями, как скорость и константа скорости реакции, энергия активации, порядок и молекулярность реакции, механизм и маршрут реакции и т. д.
Скорость химической реакции
Скорость химической реакции является важнейшей количественной характеристикой динамики химического процесса. Под скоростью гомогенной гомофазной реакции по i-веществу понимают изменение количества i-вещества (в молях, кмолях) в результате химической реакции в единицу времени в единице реакционного объема:
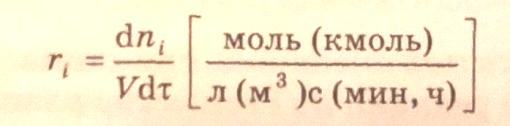
При изменении реакционного объема в ходе химической реакции выражение скорости образования i-вещества принимает вид:
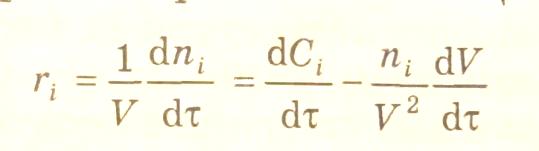
В гетерофазных и гетерогенно-каталитических процессах химическая реакция может протекать на границе раздела фаз. В этом случае выражение скорости реакции по i-веществу следует записать в виде:
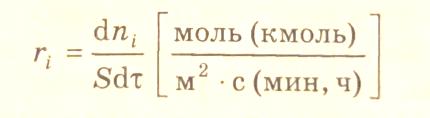
где S – поверхность раздела фаз, на которой протекает реакция.
В
гетерогенно-каталитических реакциях
активную поверхность, на которой
протекает реакция, определить, как
правило, чрезвычайно трудно. Поэтому
скорость гетерогенно-каталитического
превращения (образования) i-вещества
обычно относят к массе катализатора
 :
:
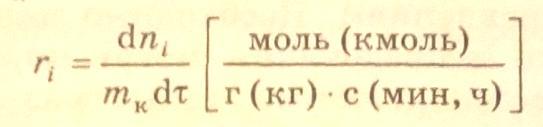
При проведении химической реакции в потоке (реактор идеального смешения или идеального вытеснения) (слайд 6) при стационарных условиях скорость реакции по i-веществу определяется как производная молярного потока i-вещества (Fi) по реакционному объему (для гомофазных реакций) или по массе катализатора (для гетерогенно-каталитических реакций) при химическом превращении:
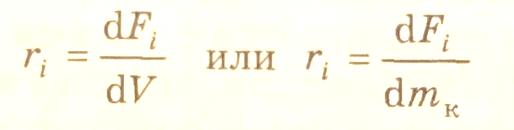
Если принять
во внимание, что в реактор идеального
вытеснения в единицу времени поступает
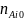 молей
молей
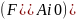 и на расстоянии l от
начала реактора степень его превращения
(конверсия) составляет
и на расстоянии l от
начала реактора степень его превращения
(конверсия) составляет
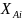 ,
то при условии стационарности
процесса уравнение скорости по i-веществу
имеет вид:
,
то при условии стационарности
процесса уравнение скорости по i-веществу
имеет вид:
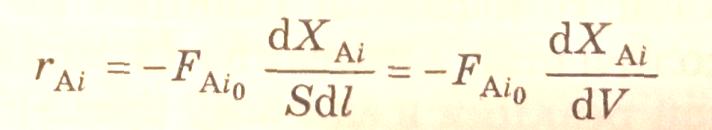
где S – площадь поперечного сечения реактора; V – реакционный объем.
В реакторе идеального смешения при стационарных условиях скорость гомофазной реакции по i-веществу равна
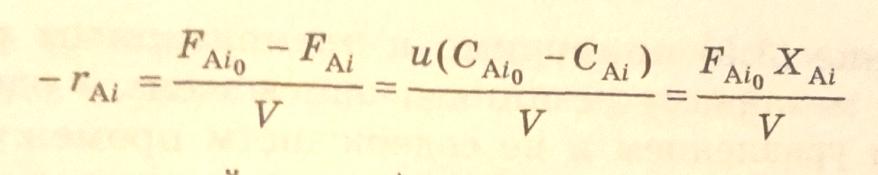
где
 и
и
 – молярный
поток
– молярный
поток
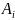 на входе и выходе из реактора соответственно;
и –
объемный поток в единицу времени;
– степень
превращения (конверсия)
.
на входе и выходе из реактора соответственно;
и –
объемный поток в единицу времени;
– степень
превращения (конверсия)
.
Важно отметить,
что при проведении реакции в реакторе
идеального смешения при стационарных
условиях скорость реакции находится
из прямого эксперимента по значениям
,
,
V или
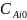 ,
,
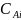 ,
объемной скорости, представляющей
отношение объемного потока в единицу
времени к реакционному объему, т. е. u/V.
,
объемной скорости, представляющей
отношение объемного потока в единицу
времени к реакционному объему, т. е. u/V.
При проведении
реакции в периодическом реакторе
или реакторе идеального вытеснения для
вычисления скорости реакции необходимо
определить производную
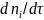 или
или
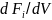 ,
,
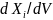 ,
соответственно, что может быть связано
со значительными погрешностями.
,
соответственно, что может быть связано
со значительными погрешностями.
При описании химического процесса одним стехиометрическим уравнением (1.1)
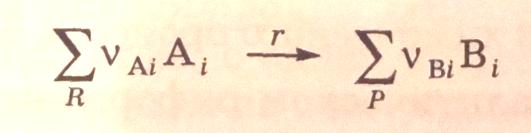
выражение скорости гомофазной реакции (r) можно получить из дифференциальных соотношений материального баланса:
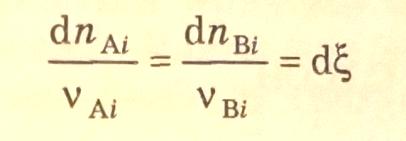
путем
деления на
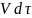 или
или
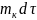 :
:
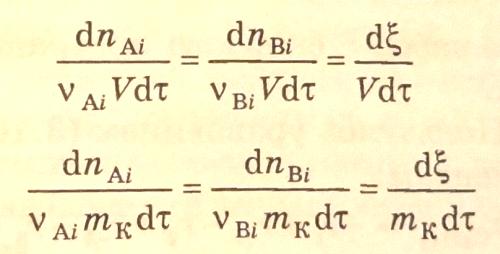
В результате проведенных преобразований получается соотношение скорости реакции по i-веществу и стехиометрическому уравнению:
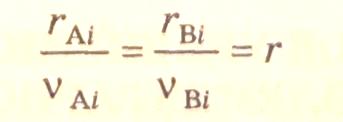
или
![]() (3.9)
(3.9)
Величина скорости реакции по стехиометрическому уравнению всегда положительна.
Выражение (3.9) применимо к элементарным реакциям и сложным по механизму реакциям, описываемым одним стехиометрическим уравнением и не содержащим промежуточных активных частиц (концентрации лабильных частиц пренебрежимо малы по сравнению с концентрациями стабильных продуктов).
При стехиометрически сложных реакциях i-вещество может образовываться и расходоваться по нескольким стехиометрически простым реакциям. В этом случае скорость по i-веществу связана со скоростями по стехиометрически простым реакциям, в которых участвует i-вещество, соотношением
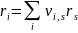 (3.10)
(3.10)
где
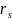 – скорость
реакции по S-стехиометрически
простому уравнению с участием i-вещества;
– скорость
реакции по S-стехиометрически
простому уравнению с участием i-вещества;
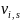 –
стехиометрический коэффициент при
веществе в S-уравнении.
–
стехиометрический коэффициент при
веществе в S-уравнении.
Для описания дифференциального баланса реакционной системы достаточно иметь уравнения скоростей реакций только для ключевых веществ, однако в правой части уравнения (3.10) необходимо учитывать все реакции химического процесса, а не только базисные.
