
- •Вапиров в.В., Ханина е.Я., Волкова т.Я. Основы электрохимии Учебное пособие для студентов инженерно-технических специальностей университетов
- •1. Окислительно-восстановительные реакции
- •1.1. Степень окисления
- •1.2. Классификация окислительно-восстановительных реакций
- •Межмолекулярные реакции
- •Реакции диспропорционирования
- •Внутримолекулярные окислительно-восстановительные реакции
- •1.3. Уравнения окислительно-восстановительных реакций
- •Метод электронного баланса
- •Метод электронно-ионного баланса
- •Электродный потенциал
- •Измерение электродного потенциала
- •Электрохимический ряд напряжений металлов
- •Окислительно-восстановительные потенциалы
- •Направление окислительно-восстановительных реакций
- •Гальванический элемент
- •3.1 Поляризация и перенапряжение
- •Подвод реагентов к электроду;
- •Собственно электрохимическая реакция;
- •Отвод продуктов реакции.
- •Электролиз
- •Для процессов на катоде:
- •При электролизе солей металлов, электродные потенциалы которых находятся между потенциалами алюминия и водорода, на катоде выделяются совместно как металлы, так и водород.
- •Для процессов на аноде:
- •В первую очередь окисляются анионы бескислородных кислот в порядке возрастания их φ (s-2, I-, Вr-, Cl-);
- •При электролизе водных растворов, содержащих анионы кислородосодержащих кислот (co32-, no3-, so42-, po43-), на аноде окисляются молекулы воды.
- •В щелочных растворах окисляются гидроксид-ионы:
- •Как протекает электролиз раствора сульфата натрия с инертными электродами.
- •Как протекает электролиз водного раствора сульфата меди с применением электродов из меди.
- •4.1. Напряжение разложения электролита. Поляризация электродов
- •4.2. Законы электролиза
- •Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества
- •При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
- •Химические источники тока
- •5.1. Топливный элемент
- •6. Коррозия
- •6.1. Химическая коррозия
- •6.2. Электрохимическая коррозия
- •6.3. Подземная коррозия
- •. Методы защиты от коррозии
- •Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Наиболее дешевым и распространенным методом являются лакокрасочные покрытия.
6. Коррозия
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Вред, причиняемый коррозией, весьма велик. По имеющимся данным, примерно треть получаемого металла выбывает из технического употребления из-за коррозии.
В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим эффектом.
В некоторых случаях коррозия поражает всю поверхность, в других – часть ее. Характер разрушения зависит от свойств металла и условий протекания процесса. На рис. 7 представлены различные виды коррозийных разрушений: равномерное (а), пятнами (б), точечное (в), питтинг (г), межкристаллитное (д), растрескивающее (Е), селективное (Ж). Наиболее опасными являеются питтинг и межкристаллитное разрушения.
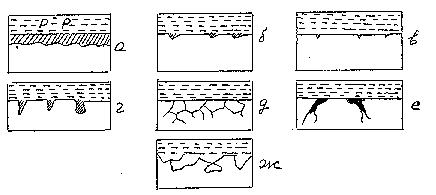
Рис. 7. Виды коррозийный разрушений
По принципу их протекания все коррозийные процессы принято подразделять на: химические и электрохимические.
6.1. Химическая коррозия
Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств).
Механизм реакции сравнительно прост. Продукты реакции образуются на тех участках металлической поверхности, которые вступили в реакцию. Так, на железе при 250-300оС появляется видимая пленка оксидов, при 600оС и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (FeO, Fe3O4, Fe2O3). Окалина не может защитить металл от дальнейшего окисления, так как содержит трещины и поры, которые позволяют проникать кислороду к металлу. При повышении температуры свыше 800оС скорость окисления железа резко увеличивается.
Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая может покрывать сплошь весь металл. Расчеты показывают, что это возможно, если объем оксида металла больше объема самого металла, пошедшего на образование этого оксида:
Vокс/Vме>1
Для щелочных и щелочно-земельных металлов это условие не соблюдается (Vокс/Vме<1). Такие пленки защитными свойствами не обладают и эти металла ввиду своей химической активности принадлежат к числу коррозионно нестойких. На алюминии и хроме образуются хорошие защитные пленки, благодаря чему металлы в атмосферных условиях коррозийно стойки (хотя химически активны). Толщина таких пленок крайне мала, например, на алюминии она достигает только 100 Å. Такие пленки состоят всего из нескольких слоев молекул и могут быть обнаружены только специальными оптическими методами.
Если металл, покрытый пленкой, продолжает корродировать, то это означает, что имеет место диффузия атомов кислорода сквозь пленку к металлу, а атомов металла – в обратном направлении. Диффузия металла и кислорода в слое твердого защитного оксида может происходить по одному из двух возможных механизмов:
а) движение ионов в междоузельном пространстве кристаллической решетки;
б) движение ионов по пустым узлам решетки.
Первый механизм имеет место при образовании пленок ZnO, CdO, BeO, Al2O3; второй – Cu2O, FeO, NiO, CoO, ZrO2, TiO2.
Диффузия катионов в защитной пленке сопровождается одновременным перемещением в том же направлении эквивалентного числа электронов в междоузлиях при первом механизме и по «электронным дефектам» (катионом с более высокой валентностью) при втором механизме. При повышении температуры окисление металлов на воздухе происходит более интенсивно (увеличивается скорость диффузии).
