- •1. Користуючись системою електромеханічних аналогій, запропонуйте механічні аналоги нелінійного опору та нелінійної провідності.
- •2. Чим, на Вашу думку, відрізняються активні лінії на базі активних провідностей та активних опорів?
- •3. Поясніть якісно, чому на високих частотах нелінійність активних ліній можна вважати слабкою.
- •4. Намалюйте миттєвий розподіл напруги вздовж активної лінії, в якій збуджені дві зустрічні хвилі, для різних початкових співвідношень між їхніми інтенсивностями. Як вони змінюватимуться з часом?
- •1. Коли синхронні коливання у середовищах, описуваних - моделлю, є стійкими щодо збурень?
- •2. Який фізичний зміст функцій () та () в рівнянні для - моделі?
- •3. Які припущення використовуються при виведенні рівняння для фазових хвиль?
- •4. Чи можна описувати короткі хвилі в автоколивному середовищі за допомогою рівняння для фазових хвиль?
- •5. Дайте фізичну інтерпретацію фазовим хвилям.
- •7. Проаналізуйте застосовність понять фазової та групової швидкості до фазових хвиль.
- •1. Чи можна впливати на кінетику відкритих (нерівноважних) систем шляхом зміни зовнішніх параметрів? Відповідь дати на прикладі горіння в комірці та моделі Шльогля.
- •2. Чому з трьох стаціонарних станів бістабільного середовища один виявляється нестійким?
- •3. Якими процесами визначається швидкість і напрямок руху біжучого фронту в середовищі, де протікає хімічна реакція, описувана моделлю Шльогля.
- •5. Якісно намалюйте фазовий потрет для хвилі гасіння
- •6. Проаналізуйте застосовність понять фазової та групової швидкості до біжучих фронтів.
- •7. Від чого залежить ширина фронту хвилі запалювання?
- •8. Якісно охарактеризуйте еволюцію довільного початкового збурення в бістабільному середовищі.
- •9. Чи залежать біжучі фронти від початкових і граничних умов? Як саме?
- •10. Чому фронт лісової пожежі звичайно буває плоским?
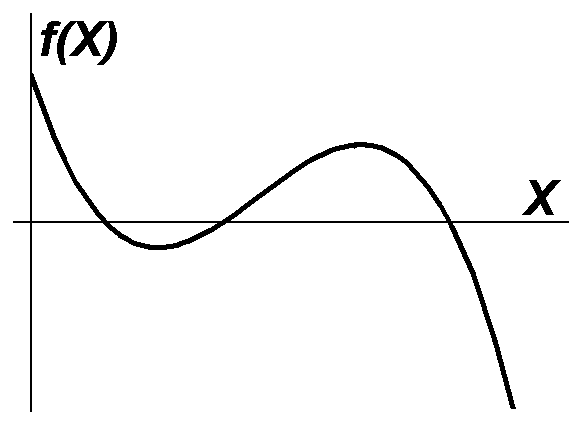
- •11. Намалюйте кінетичну функцію для середовища, в якому можливі хвилі заселення.
- •12. У чому відмінність між хвилею заселення та хвилею запалювання в бістабільному середовищі?
- •13. Знак швидкості біжучого фронту може змінюватись в залежності від параметрів моделі. Чи можливо таке для хвилі заселення.
- •14. Як швидкість хвилі заселення залежить від кривини фронту
- •5. Як зміниться профіль біжучого імпульсу при врахуванні дифузії інгібітору?
- •8. Порівняйте між собою залежності швидкості біжучого фронту в бістабільному середовищі та швидкості біжучого імпульсу в середовищі з відновленням від температури.
- •9. Проаналізуйте застосовність понять фазової та групової швидкості до біжучих імпульсів.
- •10. Опишіть еволюцію в часі середовища з відновленням, яке в початковий момент часу характеризується довільними розподілами концентрацій інгібітору та температури.
- •1. Як можна збудити періодичну хвилю в середовищі з відновленням?
- •2. Чому періодичні хвилі в середовищах із відновленням мають обмеження зверху на величину хвильового числа?
- •3. Чому зі зростанням хвильового числа швидкість періодичної хвилі в середовищі з відновленням зменшується?
- •Контрольні питання до розділу 2.1
- •1. Назвіть особливості автохвильових процесів порівняно з іншими відомими Вам типами хвиль.
- •2. Назвіть загальні властивості середовищ, у яких можуть мати місце автохвильові процеси.
- •3. Які автохвильові процеси можливі, на Вашу думку, в активному середовищі, що має три стійкі стани рівноваги?
- •4. Чи буде стійким плоский фронт біжучого імпульсу в двовимірній моделі?
- •Контрольні питання до розділу 2.2
- •1. Як пов’язані властивості середовищ із типами автохвильових процесів, що можливі в цих середовищах?
- •2. До якого типу активних середовищ належить, на Вашу думку, необмежений брюсселятор?
- •3. Порівняйте між собою періодичні автохвилі в активній лінії та в автоколивному активному середовищі.
- •1. Як, на Вашу думку, вплине врахування активних опорів на розраховану частоту генерації автогенератора на активній лінії?
- •1. Як співвідносяться максимальні частоти хвиль у вигляді одиночної та потрійної спіралі в середовищах із відновленням?
- •3. За яких початкових умов у середовищі з відновленням збуджуватиметься спіральна хвиля?
- •4. В однорідному середовищі, де можливе горіння з виділенням інгібітору, збуджена спіральна хвиля. Як залежать розміри її ядра від температури навколишнього середовища? Дайте якісне пояснення.
- •5. Як, на вашу думку, вплине врахування дифузії інгібітору на оцінку розміру ядра спіральної хвилі в порівнянні з моделлю, де така дифузія відсутня?
- •2. Опишіть часову еволюцію фазових хвиль в автоколивному середовищі, яке має два локальні максимуми для частоти локальних автоколивань.
- •3. Як, на Вашу думку, зміняться властивості пейсмекера, якщо збурення в середовищі, яке його породило, не буде аксіально-симетричним?
- •4. Як властивості локального збурення впливають на характеристики відповідного пейсмекера?
- •1. Порівняйте між собою джерела автохвиль типу поділу фронту та типу “луна”
- •Верхній графік це епюра зміни концентрації з часом, а нижній з координатою.
- •7. Намалюйте епюри зміни температури та концентрації інгібітору по обидва боки від джерела типу «луна» з урахуванням взаємної залежності температури стаціонарного стану та концентрації інгібітору.
- •Контрольні питання до розділу 2.3
- •1. Чи існує зв’язок між типами активних середовищ та типами джерел, що існують у цих середовищах?
- •2. Порівняйте між собою ревербератори в середовищах із відновленням та в середовищах автохвильового типу.
- •3. Порівняйте між собою пейсмекери та автопейсмекери.
- •4. Чи можливі, на Вашу думку, автономні джерела періодичних автохвиль у бістабільних середовищах?
- •1. Запропонуйте кілька прикладів систем, у яких можлива дифузійна нестійкість.
- •2. Чи будуть властивості структур, що виникають у двовимірній області внаслідок розвитку дифузійної нестійкості, залежати від форми цієї області?
- •1. Які рівняння використовують для аналізу конвекції Релея – Бенара?
- •2. Як залежить критичне значення різниці температур, при якому виникає конвекція, від товщини шару рідини? Запропонуйте якісне пояснення цієї залежності.
- •3. Який із стаціонарних розв’язків системи Лоренца відповідає термодинамічній гілці?
- •4. Які властивості конвекції Релея – Бенара дозволяє передбачити лінійна теорія?
- •5. Чому без урахування залежності параметрів рідини від температури теорія передбачає стійкість лише для конвективних валів?
- •6. В якому наближенні вдається аналітично проаналізувати формування шестикутних комірок Бенара?
- •7. Який із стаціонарних розв’язків системи рівнянь, що описує формування шестикутних конвективних комірок, відповідає термодинамічній гілці?
- •8. За яких умов можливе формування шестикутних комірок Бенара?
- •9. Який механізм формування шестикутних комірок Бенара?
- •10. Як можна розрахувати розмір комірок Бенара?
- •11. Чи пов’язані між собою розміри конвективних валів і шестикутних комірок для тієї самої системи?
- •12. Які властивості структур при конвекції Релея – Бенара залежать від початкових умов, а які – ні?
- •15. Глибина шару рідини, в якому відбувається конвекція Релея – Бенара, монотонно змінюється в одному напрямку. Вважаючи зміну плавною, опишіть картину утворених структур.
- •1. Опишіть якісно механізм стабілізації струму в баретері.
- •2. З яких міркувань можна визначити величину стуму, що підтримується в баретері при обмеженій зміні прикладеної напруги?
- •3. Як можна збільшити діапазон прикладених напруг, у якому баретер стабілізує струм?
- •4. Чи можливі, на Вашу думку, осциляції струму в баретері навколо критичного значення?
- •5. Чи можливий, на Вашу думку, ефект баретування, якщо високотемпературний та низькотемпературний питомі опори змінюються вздовж дротини? Відповідь обґрунтуйте.
- •6. Користуючись ступінчастою апроксимацією залежності питомого опору нитки баретера від температури, якісно зобразіть вольт-амперну характеристику баретера.
- •Контрольні питання до розділу 2.4
- •2. У чому полягає якісна відмінність між формуванням дисипативних структур у випадках баретування та конвекції Релея – Бенара?
- •3. Порівняйте між собою дисипативні структури в баретері та шарі рідини, який підігрівається знизу, з точки зору впливу початкових та граничних умов.
- •4. Порівняйте між собою автохвилі та дисипативні структури. Що в них спільного і що відмінного?
- •5. Чи можуть в одному й тому ж самому середовищі виникати автохвилі й дисипативні структури? Відповідь обґрунтувати.
7. Проаналізуйте застосовність понять фазової та групової швидкості до фазових хвиль.
Оскільки для фазових хвиль закон дисперсії ω(k)= ω0+ak2 то фазова швидкість vph=ω/k=ω0/k+ak. А оскільки ці хвилі не переносять енергію то поняття групової швидкості вводити не можна.
2.2.1
1. Чи можна впливати на кінетику відкритих (нерівноважних) систем шляхом зміни зовнішніх параметрів? Відповідь дати на прикладі горіння в комірці та моделі Шльогля.
При
розгляді авто хвильових процесів в
бістабільних середовищах, що описуються
одновимірним нелінійним кінетичним
рівнянням з дифузією
![]() ,
кінетика процесів буде визначатись
виглядом кінетичної функції
,
кінетика процесів буде визначатись
виглядом кінетичної функції
![]() .
Шляхом зміни зовнішніх параметрів можна
змінювати вигляд цієї функції, що як
результат відобразиться на кінетиці
процесів відкритих нерівноважних
систем. Зовнішні параметри можуть буди
різними в залежності від конкретної
системи.
.
Шляхом зміни зовнішніх параметрів можна
змінювати вигляд цієї функції, що як
результат відобразиться на кінетиці
процесів відкритих нерівноважних
систем. Зовнішні параметри можуть буди
різними в залежності від конкретної
системи.
В
випадку горіння в розподіленій комірці(![]() )
зміна температури навколишнього
середовища призводить до різної поведінки
системи: якщо температура навколишнього
середовища дуже низька, запалювання
взагалі неможливе (рис. 2.1.3 а); якщо
температура запалювання перевищує
температуру навколишнього середовища,
то єдино можливий стаціонарний стан –
горіння (рис. 2.1.3 б); в деякому
проміжному діапазоні значень система
формально має три стаціонарні однорідні
стани – T0,
Tс
та T1
(рис. 2.1.3 в), з яких два стійкі T0(без
горіння) та T1(з
горінням). Причому поширення хвилі
запалювання чи гасіння також залежать
від конкретного значення температури
навколишнього середовища.
)
зміна температури навколишнього
середовища призводить до різної поведінки
системи: якщо температура навколишнього
середовища дуже низька, запалювання
взагалі неможливе (рис. 2.1.3 а); якщо
температура запалювання перевищує
температуру навколишнього середовища,
то єдино можливий стаціонарний стан –
горіння (рис. 2.1.3 б); в деякому
проміжному діапазоні значень система
формально має три стаціонарні однорідні
стани – T0,
Tс
та T1
(рис. 2.1.3 в), з яких два стійкі T0(без
горіння) та T1(з
горінням). Причому поширення хвилі
запалювання чи гасіння також залежать
від конкретного значення температури
навколишнього середовища.
|
|
|
Рис. 2.1.3. Кінетичні функції для випадків відсутності горіння (а), самозапалювання (б) та можливості горіння та відсутності горіння (в). |
В
хімічній реакції за моделлю Шльогля
кінетична функція має вигляд
![]() .
Додаючи в середовище, де протікає
реакція, каталізатори, чи іншими
сторонніми чинниками впливаючи на
ймовірності протікання реакції (тобто
коефіцієнти К1А,
К2,
К3
та К4В)
можна змінювати вигляд кінетичної
функції і як наслідок кінетику процесів
в системі. Якщо величини К1А,
К2,
К3
та К4В
приблизно однакові за величиною, то
графік кінетичної функції f(x) матиме
вигляд як показано на рис. 2.1.4.
.
Додаючи в середовище, де протікає
реакція, каталізатори, чи іншими
сторонніми чинниками впливаючи на
ймовірності протікання реакції (тобто
коефіцієнти К1А,
К2,
К3
та К4В)
можна змінювати вигляд кінетичної
функції і як наслідок кінетику процесів
в системі. Якщо величини К1А,
К2,
К3
та К4В
приблизно однакові за величиною, то
графік кінетичної функції f(x) матиме
вигляд як показано на рис. 2.1.4.
|
Рис. 2.1.4. Кінетична функція для концентрації речовини Х у реакції Шльогля. |
2. Чому з трьох стаціонарних станів бістабільного середовища один виявляється нестійким?
Якщо в системі є стійкий стаціонарний стан, то це означає що при відхиленні від цього стану система буде прагнути знову повернутись до нього. Для бістабільного середовища таких станів два. Очевидно, між областями притягання стійких станів має існувати межа. За відсутності флуктуацій, якщо система знаходиться у точці, що відповідає цій межі, то сили притягання до кожної зі стійких точок мають компенсуватися й система перебуватиме в такому стані нескінченно довго, тобто межа буде треьою стаціонарною, але нестійкою точкою. Тому нестійкість третього стану пояснюється тим, що він будучи областю, де сил притягання до стійких станів компенсуються, є межею між областями, де одна із сил притягання переважає над іншою.
Нехай
маємо однорідне нелінійне кінетичне
рівняння з дифузією для бістабільного
середовища
![]() ,
д
,
д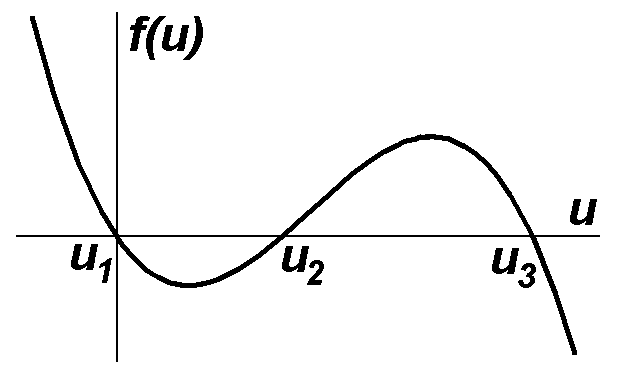 ля
того щоб розв’язок
ля
того щоб розв’язок
![]() був стійким потрібно щоб похідна від
кінетичної функції в точці
була від’ємною
був стійким потрібно щоб похідна від
кінетичної функції в точці
була від’ємною
![]() (тоді
малі відхилення від стаціонарних станів
експотенційно згасатимуть) Забезпечення
двох таких умов (
(тоді
малі відхилення від стаціонарних станів
експотенційно згасатимуть) Забезпечення
двох таких умов (![]() ,
,
![]() )
при нерозривній кінетичній функції
можливе тільки в тому випадку, коли
існує ще один розв’язок
)
при нерозривній кінетичній функції
можливе тільки в тому випадку, коли
існує ще один розв’язок
![]() ,
де
,
де
![]() (тобто нестійкий стаціонарний
розв’язок).Тобто це фактично результат
тго що
це розвязки нелінійного кінетичного
рівняння з дивфузією
яке по суті є рівнянням неперервності
для величини
(тобто нестійкий стаціонарний
розв’язок).Тобто це фактично результат
тго що
це розвязки нелінійного кінетичного
рівняння з дивфузією
яке по суті є рівнянням неперервності
для величини
![]() за наявності джерел та додатковим
припущеням, що потік
за наявності джерел та додатковим
припущеням, що потік
![]() величини
рівний
величини
рівний
![]()

 а
а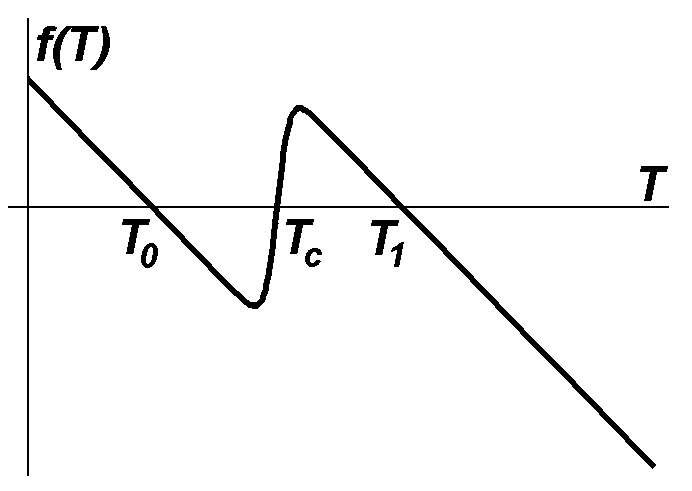 в
в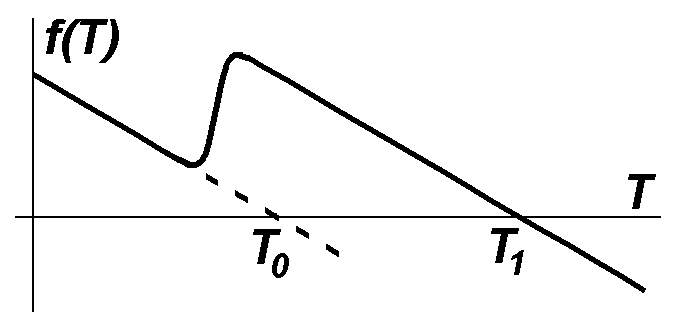 б
б