
- •Введение
- •Кинематика поступательного движения Введение
- •Кинематика поступательного движения. Основные кинематические характеристики
- •Скорость
- •Ускорение
- •Равнопеременное прямолинейное движение
- •Динамика поступательного движения Основные законы динамики
- •Первый закон Ньютона
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Закон изменения импульса
- •Закон сохранения импульса
- •Реактивное движение
- •Разновидности сил, играющих важную роль в механических процессах Классификация фундаментальных взаимодействий, известных современной физике
- •Сила трения
- •Закон Гука
- •Сила тяготения
- •Центростремительная сила
- •Работа и энергия
- •Работа нескольких сил, приложенных к телу
- •Мощность
- •Энергия
- •Вращательное движение твердого тела
- •Момент инерции тела
- •Теорема Штейнера
- •Момент силы
- •Кинематические характеристики вращательного движения твердого тела
- •Основной закон динамики вращательного движения (аналог второго закона Ньютона)
- •Кинетическая энергия вращающегося тела
- •Момент импульса
- •Поступательным и вращательным движением
- •Закон изменения и сохранения момента импульса
- •Сумма моментов импульсов тел, составляющих замкнутую систему, есть величина постоянная.
- •Практические приложения закона сохранения момента импульса
- •Гармонические колебания
- •Уравнение гармонического колебания
- •Кинематические характеристики гармонического колебательного движения
- •Сложение гармонических колебаний
- •3. Сложение двух взаимно перпендикулярных гармонических колебаний
- •4. Частные случаи
- •Стоячие волны
- •Постулаты специальной теории относительности
- •Постулаты Эйнштейна
- •1. Принцип относительности.
- •Преобразования Лоренца
- •Следствия из преобразований Лоренца
- •Основной закон релятивистской динамики для материальной точки
- •Закон взаимосвязи массы и анергии
- •Молекулярная физика. Основные положения молекулярно-кинетической теории строения вещества
- •Вывод основного уравнения молекулярно кинетической теории идеального газа (уравнения Клаузиуса)
- •Уравнение Больцмана
- •Связь между давлением и температурой газа
- •Распределение молекул по скоростям и энергиям. Барометрическая формула
- •Число степеней свободы
- •Внутренняя энергия идеального газа
- •Первое начало термодинамики. Работа газа. Теплоемкость Основные понятия
- •Работа газа
- •Первое начало термодинамики
- •Теплоемкость газа
- •Адиабатический процесс
- •Второе начало термодинамики
- •Теорема Карно
- •Энтропия по Клаузиусу
- •Энтропия по Больцману
- •Явления переноса
- •Реальные газы Агрегатные состояния
- •Фазовые переходы
- •Эффект Джоуля-Томсона
- •Изотермы Ван-дер-Ваальса
- •Эффект Джоуля-Томсона для газа Ван-дер-Ваальса
- •Свойства жидкостей Поверхностное натяжение
- •Капиллярные явления
- •Свойства твердых тел Строение кристаллов
- •Кристаллизация, плавление и типы решеток
- •Тепловое расширение
- •Теплоемкость твердых тел
- •Основы гидродинамики Течение жидкости. Неразрывность струи
- •Уравнение Бернулли
- •Электростатика Электрические заряды. Закон Кулона
- •Закон сохранения электрического заряда
- •Закон Кулона
- •Напряженность электрического поля
- •Принцип суперпозиции полей
- •Силовые линии
- •Теорема Гаусса-Остроградского. Вычисление полей Поток вектора напряженности электрического поля
- •Теорема Гаусса-Остроградского
- •Напряженность поля равномерно заряженной бесконечной плоскости
- •Напряженность электрического поля между разноименно заряженными пластинами
- •Напряженность электрического поля равномерно заряженной тонкой нити бесконечной длины
- •Напряженность электрического поля равномерно заряженной сферы
- •Потенциал электрического поля. Потенциальная энергия взаимодействия зарядов
- •Работа точечного заряда по перемещению пробного заряда
- •Потенциальная энергия взаимодействия системы зарядов
- •Электрический потенциал
- •Связь между электрическим потенциалом и напряженностью электрического поля
- •Эквипотенциальные поверхности
- •Проводники в электрическом поле
- •1. Свойства проводников
- •2. Электрическая емкость
- •3. Энергия электростатического поля
- •Диэлектрики в электрическом поле
- •Постоянный электрический ток
- •1. Сила и плотность тока
- •2. Закон Ома
- •Электрические цепи
- •Закон Ома для полной цепи:
- •Контактные явления Работа выхода
- •Законы Вольта
- •Контактная разность потенциалов
- •Термоэлектрические явления
- •Электрический ток в полупроводниках
- •Собственная проводимость полупроводников
- •Примесная проводимость полупроводников
- •Контакт р- и п-полупроводников. Полупроводниковый диод
- •Магнитное поле токов
- •1. Магнитное поле и его характеристики
- •2. Закон Био-Савара-Лапласа
- •Напряженность поля в центре кругового витка
- •Напряженность поля прямолинейного проводника с током
- •Напряженность поля соленоида и тороида
- •Действие магнитного поля на проводник с током и движущийся заряд Закон Ампера
- •Сила Лоренца
- •Движение заряженной частицы в магнитном поле
- •Работа по перемещению
- •Магнитные свойства вещества
- •1. Парамагнетизм и диамагнетизм
- •Ферромагнетизм
- •Закон электромагнитной индукции Фарадея Энергия магнитного поля
- •Закон электромагнитной индукции Фарадея
- •Колебательный контур. Излучение электромагнитных волн
- •Уравнения Максвелла. Электромагнитные волны
- •Свет и его свойства. Геометрическая оптика Свойства света
- •Геометрическая оптика
- •Дисперсия света
- •Типы спектров
- •Основные фотометрические характеристики
- •Интерференция света Условия возникновения и сущность явления интерференции
- •Условия максимумов и минимумов интерференционной картины
- •Применение интерференции света.
- •Дифракция света Принцип Гюйгенса-Френеля. Зоны Френеля
- •Дифракция Френеля
- •Дифракция Фраунгофера
- •Поляризация света Естественный и поляризованный свет
- •Поляризация при двойном лучепреломлении
- •Вращение плоскости поляризации
- •Законы теплового излучения
- •Свойства теплового излучения
- •Характеристики теплового излучения
- •Поглощательные характеристики тела
- •Понятие абсолютно черного тела
- •Законы излучения абсолютно черного тела
- •Формула Планка
- •Квантовые свойства электромагнитного излучения. Внешний фотоэффект
- •Масса и энергия фотона Световое давление
- •Эффект Комптона
- •Строение атома водорода по Бору
- •Первый постулат Бора.
- •Второй постулат Бора.
- •Элементы квантовой механики. Частица в одномерной потенциальной яме Корпускулярно-волновой дуализм
- •Общее нерелятивистское уравнение Шредингера
- •Стационарное уравнение Шредингера
- •Строение ядра атома. Виды радиоактивного распада
- •Закон радиоактивного распада
- •Цепная реакция. Устройство и принцип действия ядерного реактора
- •Биологическое действие радиоактивных излучений Элементы дозиметрии радиоактивных излучений
- •Источники радиоактивных излучений
- •Действие облучения на органы и ткани
- •Механизм биологического действия радиации
- •Практическое использование ионизирующих излучений
- •Современные представления о строении элементарных частиц. Лептоны, кварки, глюоны. Кварки
- •Лептоны
- •Физический вакуум
- •Виртуальные частицы
- •Строение и эволюция Вселенной
- •Закон эволюции. Критическая плотность
Число степеней свободы
Числом
степеней свободы называется минимальное
число координат, с помощью которого
можно однозначно описать положение
молекулы в пространстве. Очевидно, что
для фиксации положения одноатомной
молекулы (материальной точки) достаточно
трех координат (х, у,
z).
Поэтому для нее i
=
3. Для двухатомной молекулы, в случае
жесткой связи между атомами, i
=
5,
так как для задания положения каждого
из атомов нужно иметь три координаты,
для двух атомов соответственно шесть
координат, но из-за жесткой связи эти
шесть координат![]() связаны
между собой с помощью одного уравнения.
Поэтому шестую координату можно
вычислить, зная пять других.
связаны
между собой с помощью одного уравнения.
Поэтому шестую координату можно
вычислить, зная пять других.
Можно рассуждать иначе — для задания положения центра тяжести молекулы в пространстве достаточно трех координат. Если добавить к ним еще два угла поворота относительно двух взаимно перпендикулярных осей, перпендикулярных к оси, соединяющей атомы, то для однозначного определения положения молекулы в пространстве достаточно пяти координат. Поворот молекулы относительно оси, проходящей через атомы, очевидно ее положения не меняет. Поэтому говорят о наличии у двухатомной молекулы трех поступательных и двух вращательных степеней свободы.
Рассуждая аналогично, можно показать, что в случае жестких связей многоатомная (трех и более) молекула имеет шесть степеней свободы — три поступательных и три вращательных (рис. 4).
При высоких температурах (Т > 2000К) у молекул появляются дополнительные колебательные степени свободы. Далее будем считать все связи между атомами в молекуле жесткими.
Постулат Больпмана. В среднем на каждую степень свободы молекулы приходится одинаковая энергия, равная кТ/2. Значит энергия молекул равномерно распределяется по степеням свободы частиц. Таким образом средняя энергия молекулы, обладающей i степенями свободы, равна
![]()
где к — постоянная Больпмана, Т — абсолютная температура.
Внутренняя энергия идеального газа
Поскольку
для идеального газа энергия межмолекулярного
взаимодействия равна нулю, то внутренняя
энергия идеального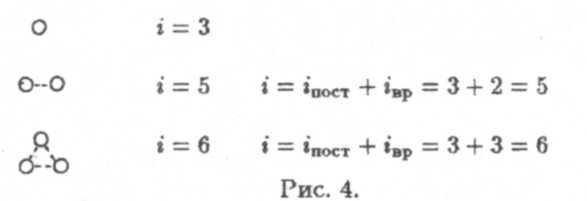 газа есть сумма кинетических энергий
составляющих его молекул. Поэтому
газа есть сумма кинетических энергий
составляющих его молекул. Поэтому
![]()
где N — число молекул газа, Na — 6,02 • 1023 моль- — число Авогадро, т — масса газа, μ — молярная масса, R — к • Na — универсальная газовая постоянная.
Как показывает формула (14), внутренняя энергия идеального газа пропорциональна его температуре. Она также тем больше, чем больше число степеней свободы молекул газа. Часто формулу (14) записывают в виде
![]()
Здесь величина Сv — iR/2 имеет смысл молярной теплоемкости газа при постоянном объеме. Более подробно вопрос о трансформации энергии, сообщаемой идеальному газу, будет рассмотрен нами в следующей лекции.
Лекция № 12
Первое начало термодинамики. Работа газа. Теплоемкость Основные понятия
Термодинамика — это учение о связи и взаимопревращениях различных видов энергии теплоты и работы. Термодинамика основывается на двух опытных законах или началах. Первое начало термодинамики представляет собой закон сохранения энергии применительно к термодинамике, однако, оно не указывает направления тепловых процессов. Это направление указывает второе начало термодинамики, определяя также наибольшие возможные превращения теплоты в работу при круговых процессах. Это имеет исключительно важное значение для техники. Введем некоторые основные понятия термодинамики.
Термодинамическая система — макроскопическое тело или группа тел, которым свойственны процессы, сопровождающиеся переходом теплоты в другие виды энергии и обратные процессы. Термодинамические параметры — величины давления р, объема V и температуры T, полностью характеризующие состояние системы.
Внутренняя анергия тела U включает в себя кинетическую энергию хаотического движения молекул, потенциальную энергию их взаимодействия, кинетическую и потенциальную энергии колебательного движения атомов в молекулах и внутриатомную энергию.
Молекулярно-кинетическая теория идеального газа с учетом только кинетической энергии движения молекул дает формулу:
![]()
Внутренняя энергия является функцией состояния, т.е. она зависит только от термодинамических параметров данного состояния U = f(p,V,T). Изменение внутренней энергии AU = U2 — U1 определяется начальным и конечным состоянием системы.
Количество теплоты Q — количество энергии отданное или полученное телом в процессе теплопередачи. Это мера той части внутренней энергии, которая обусловлена хаотическим движением частиц. Зависит от пути перехода системы из одного состояния в другое.
Работа А — мера переданной другому телу и телам механической энергии. И работа и количество теплоты не являются отдельными формами энергии, они проявляются в процессе передачи энергии.
Количество теплоты и работы эхвивиалептпы, т.е. это вза-имопревращаемые формы передачи энергии и в реальных условиях они сопутствуют друг другу. Это было доказано в конце 18 - середине 19 века на многочисленных опытах, венцом которых стал опыт Джоуля по установлению механического эквивалента теплоты. В системе СИ [Q] = [А] = Дж.
