
- •1 Семестр лабораторная работа №1
- •1.1 Универсальные реакции на белки
- •Цветные реакции на отдельные аминокислоты
- •Практическая значимость работы
- •2.4 Оформление работы
- •2.1 Обратимое и необратимое осаждение белков
- •2.2 Практическая значимость работы
- •2.3 Оформление работы
- •Лабораторная работа №2
- •Биуретовая реакция на пептиды
- •Серебряная проба на пуриновые основания
- •Качественная реакция на пентозу (Молиша)
- •Качественная реакция на углевод
- •Реакция на дезоксирибозу и рибозу
- •Молибденовая проба на фосфорную кислоту
- •Лабораторная работа №3
- •1. Влияние неспецифических факторов на активность ферментов
- •2. Влияние температуры на активность ферментов
- •3. Влияние реакции среды на активность ферментов и определение оптимума рН для амилазы слюны
- •4. Влияние активаторов и ингибиторов на активность амилазы слюны
- •Лабораторная работа №4
- •Раздел 1. Качественные реакции на водорастворимые и жирорастворимые витамины
- •1.1. Качественная реакция на витамин в1 (тиамин)
- •1.2. Качественная реакция на витамин в2 (рибофлавин)
- •1.7. Качественная реакция на витамин е
- •Раздел 2. Количественное определение витамина с
- •Лабораторная работа 5
- •1. Изучение активности сукцинатдегидрогеназы
- •2. Изучение активности малатдегидрогеназы
- •3. Изучение активности цитохромоксидазы мышц
- •4. Исследование окислительного фосфорилирования в митохондриях
- •Лабораторная работа 6
- •1. Изучение функционирования цтк по убыли ацетил КоА
- •2. Изучение функционирования цтк по образованию со2
- •3. Изучение функционирования цтк по образованию атомов водорода
- •Лабораторная работа 7
- •Лабораторная работа 8
- •2 Семестр лабораторная работа № 1
- •Лабораторная работа № 2
- •1. Проба Легаля.
- •2. Проба Ланге.
- •Лабораторная работа № 3
- •Лабораторная работа № 4
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7
- •1. Определение коэффициента пересчета к.
- •2. Ход определения.
- •Меры предосторожности.
- •Лабораторная работа № 8
- •I. Качественные реакции на инсулин.
- •Лабораторная работа. № 9
- •Лабораторная работа № 11
- •Лабораторная работа № 12
Лабораторная работа № 4
Тема: Количественное определение активности аланинаминотрансферазы (АлАТ) в сыворотке крови
Цель: Изучить активность аланинаминотрансферазы (АлАТ) в сыворотке крови, ее значение для диагностики гепатита.
Принцип метода: Аминотрансферазы или трансаминазы катализируют межмолекулярный перенос аминогруппы с амнокислот на кетокислоты. Коферментом трансаминаз является фосфопиридоксаль, который служит непосредственным переносчиком аминогрупп с аминокислоты на кетокислоту. АлАТ катализирует реакцию переаминирования между аланином и -кетоглутаровой кислотой:
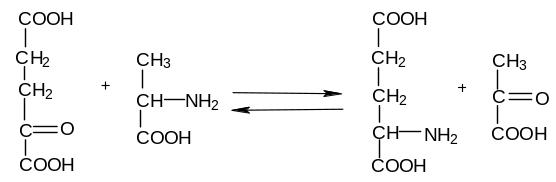
α-кетоглутарат |
Аланин |
Глутамат |
пируват |
По количеству образовавшейся пировиноградной кислоты можно судить об активности фермента. Количество пировиноградной кислоты определяется колориметрическим путем по цветной реакции с 2,4-динитрофенилгидразином, при которой развивается красно-бурое окрашивание:
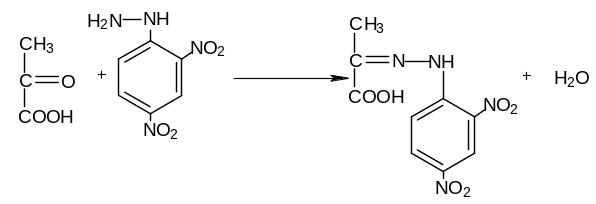
Пируват |
2,4-ДНФГ |
2,4-ДНФ-гидразон пирувата |
Повышение активности АлАТ наблюдается при заболеваниях печени, а повышение активности АсАТ – при патологии сердечной мышцы.
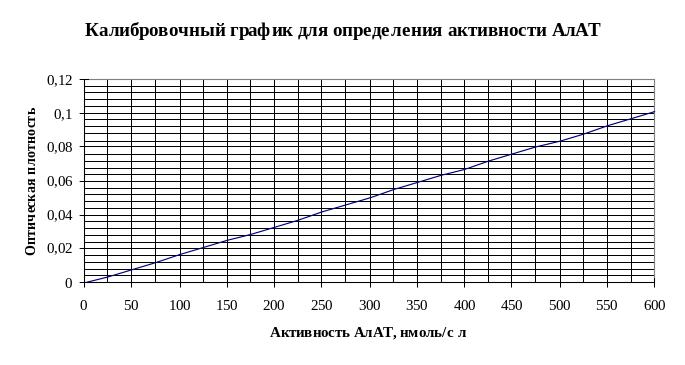
Активность АлАТ в норме составляет 28 – 190 нмоль/сл
Схема постановки опыта
|
Контрольная проба |
Опытная проба |
Реагент 1 (АлАТ, субстрат), мл |
0,25 |
0,25 |
Дистиллированная вода, мл |
0,05 |
– |
Сыворотка, мл |
– |
0,05 |
Перемешать и инкубировать 30 мин |
||
Реагент 2 (динитрофенилгидразин), мл |
0,25 |
0,25 |
Перемешать и оставить при комнатной температуре на 20 мин |
||
NaOH (С = 0,4 моль/л), мл |
2,5 |
2,5 |
Перемешать и через 10 минут измерить оптическую плотность пробы против контрольной пробы при длине волны 540 нм, кювета с толщиной слоя 5 мм. Активность АлАТ в опытной пробе определить по калибровочному графику в нмоль/сл.
Лабораторная работа № 5
Тема: Определение мочевины в сыворотке крови и в моче по цветной реакции с диацетилмонооксимом
Цель: научиться определять содержание мочевины в сыворотке крови и моче, изучить значение данного показателя для диагностики патологий.
Принцип метода: мочевина образует окрашенный продукт при взаимодействии с диацетилмонооксимом, интенсивность окраски определяется фотоколориметрически и пропорциональна концентрации мочевины в пробе.
Ход определения: в пробирки внести реактивы по следующей схеме:
|
Холостая проба, мл |
Калибровочная проба (Dk), мл |
Опытная проба (Do), мл |
Образец |
- |
- |
0,01 |
Калибровочный раствор мочевины |
- |
0,01 |
- |
Рабочий раствор |
2,00 |
2,00 |
2,00 |
Содержимое пробирок тщательно перемешивают, отверстие закрывают алюминиевой фольгой и пробирки помещают точно на 10 минут в кипящую водяную баню. Затем пробирки быстро охлаждают в потоке холодной воды и измеряют оптическую плотность при 510 нм (490 – 540 нм, зеленый светофильтр) против холостой пробы в кювете с толщиной поглощающего слоя 1,0 или 0,5 см. Параллельно обрабатывают калибровочный раствор. Окраска устойчива в течение 15 минут.
Расчет содержания мочевины производят по формуле:
С =
![]() ;
;
где С – содержание мочевины в опытной пробе, ммоль/л;
Do – оптическая плотность опытной пробы;
Dк – оптическая плотность калибровочной пробы;
8,0 – содержание5 мочевины в калибровочном растворе, ммоль/л
Нормальные показатели концентрации мочевины:
в сыворотке (плазме) крови 2,5 – 8,3 ммоль/л
в моче 333 – 583 ммоль/сут
Результат анализа:
