
- •Основные понятия термодинамики.
- •1. Изолированные (нет обмена ни веществом, ни энергией с окружающей
- •2. Замкнутые (нет обмена веществом с окружающей средой). Пример –
- •3. Открытые (есть и энерго- и массообмен с окружающей средой).
- •5. Зависимость скорости химической реакции от концентрации реагентов. Кинетические уравнения реакция первого, второго и нулевого порядков.
- •6. Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. Уравнение Аррениуса.
- •9 . Роль воды и растворов в жизнедеятельности. Термодинамика растворения.
- •13. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури. Теория Льюиса.
- •26.Оптические свойства: рассеивание света. Электрокинетические свойства: электроосмос и электрофорез. Строение двойного электрического слоя.
- •30. Коллоидные пав. Биологически важные коллоидные пав (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах пав. Липосомы.
- •31.Окислительно-восстановительное титрование.
- •34.Окислительно-восстан системы. Потенциалы, механизм возникновения, био значение.
- •Классификация органических соединений
- •Виды ковалентной связи
- •Реакции нуклеофильного замещения
- •Реакции электрофильного замещения
- •Рекции радикального замещения
- •Химические свойства
- •Химические свойства
- •Структура тройной связи
- •Химические свойства
- •Химические свойства алкадиенов
- •Критерии ароматичности
- •Правило Хюккеля
- •Современные представления
Химические свойства
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Реакции электрофильного присоединения
В данных реакциях атакующей частицей является электрофил.
Галогенирование
Галогенирование алкенов, проходящее в отсутствии инициаторов радикальных реакций — типичная реакция электрофильного присоединения. Она проводится в среде неполярных инертных растворителей (например: CCl4):
![]()
Гидрогалогенирование
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:
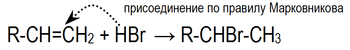
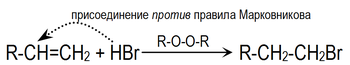
Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму:
Гидроборирование
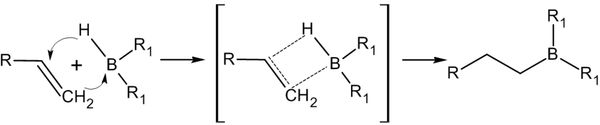
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причем присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода:
Гидратация
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты[20]:
![]()
Реакция протекает по правилу Марковникова.
Алкилирование
Присоединение алканов к алкенам в присутствии кислотного катализатора (HF или H2SO4) при низких температурах приводит к образованию углеводорода с большей молекулярной массой и часто используется в промышленности[29]:
![]()
Данная реакция также может протекать по свободнорадикальному механизму в отсутствие катализатора при высокой температуре (500 °C) и давлении (15-30 МПа)[20].
41
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил»
Структура тройной связи
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
