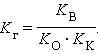- •Силлабус
- •5В071700 – Теплоэнергетика Астана
- •Силлабус по дисциплине ''Химия»
- •6. Список основной и дополнительной литературы
- •7. Контроль и оценка результатов обучения
- •Политика учебной дисциплины
- •Глоссарий по дисциплине «Химия»
- •Основные законы химии. Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •Гипотеза Планка. Кванты света.
- •Строение атома по теории Бора.
- •2. Волновая функция. Уравнение Шредингера. Понятие об электронном облаке,
- •2. Принцип Паули, правило Гунда. Заполнения атомных орбиталей.
- •Лекция № 5 (проблемная) Периодический закон. Периодическая система элементов.
- •Периодический закон. Периодическая система д.И.Менделеева.
- •2. Периодичность атомных характеристик.
- •Лекция № 6 Развитие представлений о химической связи.
- •1. Развитие представлений о химической связи.
- •Теория Льюиса. Понятие о ковалентной связи.
- •Теория Косселя. Ионная связь.
- •Лекция № 7 Метод валентных связей.
- •1. Метод валентных связей.
- •2.Теория гибридизации атомных орбиталей.
- •3. Кратные связи.
- •Лекция № 8 (проблемная)
- •I закон термодинамики.
- •1. Введение в термохимию.
- •2. I закон термодинамики. Энтальпия.
- •Тепловой эффект реакции. Закон Гесса.
- •2. Энергия Гиббса.
- •Факторы, влияющие на скорость химических реакций.
- •2. Химическое равновесие. Принцип Ле - Шателье.
- •3. Факторы, влияющие на химическое равновесие.
- •2. Концентрация растворов
- •3. Растворы неэлектролитов. Законы Рауля. Осмос.
- •2. Закон разбавления Оствальда.
- •3. Диссоциация воды. Водородный показатель pH.
- •4. Гидролиз солей
- •Лекция № 14 Окислительно-восстановительные реакции.
- •4. Классификация окислительно-восстановительных реакций.
- •2. Важнейшие восстановители и окислители.
- •3. Составление уравнений окислительно-восстановительных реакций
- •4. Классификация окислительно-восстановительных реакций. Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •2. Гальванические элементы
- •3. Электролиз
- •4. Законы электролиза (м. Фарадей)
- •Карта учебно-методической обеспеченности дисциплины
- •График выполнения и сдачи заданий срс
- •График выполнения и сдачи заданий срсп по дисциплине «Химия».
- •График выполнения и сдачи заданий срс по дисциплине «Химия».
- •30 Часов срс
- •Лабораторная работа № 1.
- •Химическая посуда и лабораторное оборудование Стеклянная посуда общего назначения.
- •Лабораторная работа № 2.
- •Лабораторная работа № 3
- •Лабораторная работа № 4
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7
- •Лабораторная работа № 8
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Лабораторная работа № 12
- •Опыт 1. Приготовление 0,1 н. Раствора соляной кислоты.
- •Контрольные вопросы и задачи.
- •Лабораторная работа № 13
- •Лабораторная работа № 14
- •Лабораторная работа № 15
- •Вопросы по теме "Строение атома"
- •Контрольные вопросы и задачи
- •Химическая связь
- •Основные вопросы по теме « химическая связь»
- •Контрольные вопросы и задачи по теме « химическая связь»
- •Химическая термодинамика
- •Контрольные вопросы и задачи по теме "Химическая кинетика".
- •Основные вопросы по теме «химическая кинетика и равновесие»
- •Контрольные вопросы и задачи по теме «Растворы»
- •Основные вопросы по теме «растворы»
- •Контрольные вопросы и задачи по теме «Растворы электролитов»
- •Растворы
- •Контрольные вопросы и задачи по теме «Окислительно-восстановительные реакции».
- •Химические источники тока
- •Контрольные вопросы и задачи по теме Химические источники тока
- •Задачи с решением по теме «Строение атома»
- •Задачи с решением по теме «Химическая связь».
- •Задачи с решением по теме «Термодинамика».
- •Задачи с решением по теме «Кинетика»
- •Задачи с решением по теме «Окислително-восстановительные процессы».
- •Контрольная работа по теме «Химическая кинетика»
- •1 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •2 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •3 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •4 Вариант
2. Закон разбавления Оствальда.
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
![]()
Константа равновесия Kc этой реакции и есть Kд:
![]()
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим

Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
![]()
Тогда
![]()
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда изотонический коэффициент можно записать в виде
![]()
Решая его относительно α, получим
![]()
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
-
Реакция
Константа диссоциации Kд
Степень диссоциации α
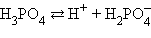
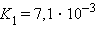
α = 27 %
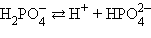
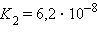
α = 0,15 %
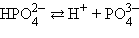
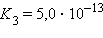
α = 0,005 %
3. Диссоциация воды. Водородный показатель pH.
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
![]()
ее константа при 298 K равна
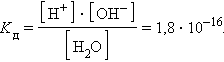
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
![]()
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
![]()
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов:
pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
4. Гидролиз солей
В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита. Возможность и характер протекания гидролиза определяется природой соли:
![]()
![]()
![]()
![]()
![]()
![]()
В первом случае гидролиз идет по катиону и pH < 7, во втором по аниону – pH > 7, а в третьем – по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Константа равновесия для первого случая
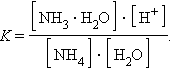
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда
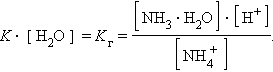
Умножив числитель и знаменатель на [OH–], получим
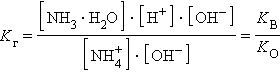
Аналогично для гидролиза по аниону
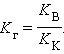
Для гидролиза по катиону и аниону одновременно