- •Силлабус
- •5В071700 – Теплоэнергетика Астана
- •Силлабус по дисциплине ''Химия»
- •6. Список основной и дополнительной литературы
- •7. Контроль и оценка результатов обучения
- •Политика учебной дисциплины
- •Глоссарий по дисциплине «Химия»
- •Основные законы химии. Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •Гипотеза Планка. Кванты света.
- •Строение атома по теории Бора.
- •2. Волновая функция. Уравнение Шредингера. Понятие об электронном облаке,
- •2. Принцип Паули, правило Гунда. Заполнения атомных орбиталей.
- •Лекция № 5 (проблемная) Периодический закон. Периодическая система элементов.
- •Периодический закон. Периодическая система д.И.Менделеева.
- •2. Периодичность атомных характеристик.
- •Лекция № 6 Развитие представлений о химической связи.
- •1. Развитие представлений о химической связи.
- •Теория Льюиса. Понятие о ковалентной связи.
- •Теория Косселя. Ионная связь.
- •Лекция № 7 Метод валентных связей.
- •1. Метод валентных связей.
- •2.Теория гибридизации атомных орбиталей.
- •3. Кратные связи.
- •Лекция № 8 (проблемная)
- •I закон термодинамики.
- •1. Введение в термохимию.
- •2. I закон термодинамики. Энтальпия.
- •Тепловой эффект реакции. Закон Гесса.
- •2. Энергия Гиббса.
- •Факторы, влияющие на скорость химических реакций.
- •2. Химическое равновесие. Принцип Ле - Шателье.
- •3. Факторы, влияющие на химическое равновесие.
- •2. Концентрация растворов
- •3. Растворы неэлектролитов. Законы Рауля. Осмос.
- •2. Закон разбавления Оствальда.
- •3. Диссоциация воды. Водородный показатель pH.
- •4. Гидролиз солей
- •Лекция № 14 Окислительно-восстановительные реакции.
- •4. Классификация окислительно-восстановительных реакций.
- •2. Важнейшие восстановители и окислители.
- •3. Составление уравнений окислительно-восстановительных реакций
- •4. Классификация окислительно-восстановительных реакций. Межмолекулярные окислительно-восстановительные реакции
- •Внутримолекулярные окислительно- восстановительные реакции
- •2. Гальванические элементы
- •3. Электролиз
- •4. Законы электролиза (м. Фарадей)
- •Карта учебно-методической обеспеченности дисциплины
- •График выполнения и сдачи заданий срс
- •График выполнения и сдачи заданий срсп по дисциплине «Химия».
- •График выполнения и сдачи заданий срс по дисциплине «Химия».
- •30 Часов срс
- •Лабораторная работа № 1.
- •Химическая посуда и лабораторное оборудование Стеклянная посуда общего назначения.
- •Лабораторная работа № 2.
- •Лабораторная работа № 3
- •Лабораторная работа № 4
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7
- •Лабораторная работа № 8
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Лабораторная работа № 12
- •Опыт 1. Приготовление 0,1 н. Раствора соляной кислоты.
- •Контрольные вопросы и задачи.
- •Лабораторная работа № 13
- •Лабораторная работа № 14
- •Лабораторная работа № 15
- •Вопросы по теме "Строение атома"
- •Контрольные вопросы и задачи
- •Химическая связь
- •Основные вопросы по теме « химическая связь»
- •Контрольные вопросы и задачи по теме « химическая связь»
- •Химическая термодинамика
- •Контрольные вопросы и задачи по теме "Химическая кинетика".
- •Основные вопросы по теме «химическая кинетика и равновесие»
- •Контрольные вопросы и задачи по теме «Растворы»
- •Основные вопросы по теме «растворы»
- •Контрольные вопросы и задачи по теме «Растворы электролитов»
- •Растворы
- •Контрольные вопросы и задачи по теме «Окислительно-восстановительные реакции».
- •Химические источники тока
- •Контрольные вопросы и задачи по теме Химические источники тока
- •Задачи с решением по теме «Строение атома»
- •Задачи с решением по теме «Химическая связь».
- •Задачи с решением по теме «Термодинамика».
- •Задачи с решением по теме «Кинетика»
- •Задачи с решением по теме «Окислително-восстановительные процессы».
- •Контрольная работа по теме «Химическая кинетика»
- •1 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •2 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •3 Вариант
- •Контрольная работа по теме «Химическая кинетика»
- •4 Вариант
3. Кратные связи.
π - и δ – связи налагаются на σ – связи, вследствии чего образуются двойные и тройные связи. Представление о кратных связях широко используют при изучении органической химии. Например, в молекуле этана одинарная связь образуется двумя электронами, находящимися на двух sp3-гибридизированных орбиталях связывающихся атомов углерода (по одному электрону на каждой из орбиталей).
Между атомами углерода в молекуле этилена двойная связь представляет собой уже упомянутую σ-связь, помимо которой образуется еще и связь с помощью двух других электронов, находившихся первоначально на негибридизированных p-орбиталях атома углерода (так называемая π-связь).
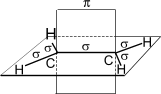
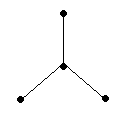
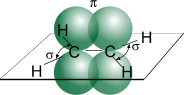 Рисунок. Схематическое изображение
строения молекулы этилена
Рисунок. Схематическое изображение
строения молекулы этилена
Двойные связи
также возникают при образовании молекул
СО2
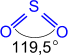 ,
некоторых кислот и т.п.
,
некоторых кислот и т.п.
Наконец, в случае тройной связи (между атомами углерода в молекуле ацетилена) к уже имеющимся σ-связи и π-связи добавлется еще одна π-связь. Линейная структура sp-гибридизированных орбиталей обусловливает линейную структуру молекулы ацителена.
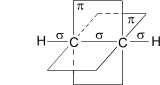
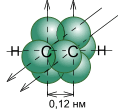
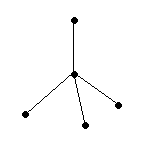
Рисунок. Схематическое изображение строения молекулы ацетилена
Тройная связь также возникает при образовании молекулы азота (:NºN:).
Количество связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением порядка связи изменяются длина связи (уменьшается) и ее энергия (увеличивается). При химических реакциях сравнительно легко разрываются π - связи, причем третья легче второй, а вторая легче первой, т.е. σ – связи. Соединения с тройной связью обладают большей реакционной способностью, чем соединения с двойной связью.
Задание на дом: В рамках метода ВС объясните структуры молекул Н2, Cl2, O2, N2, HCl, Н2О, BeH2, ВСl3, BH4-, NH4+, указав число локализованных электронных пар.
|