
- •Лекції з фізики основи молекулярної фізики і термодинаміки
- •Лекція 8
- •Основи молекулярної фізики і термодинаміки
- •Молекулярно-кінетична теорія ідеального газу
- •Основні положення молекулярно-кінетичної теорії
- •Статистичний і термодинамічний методи
- •Макроскопічні параметри стану речовини
- •Ідеальний газ. Дослідні закони ідеального газу
- •Рівняння стану ідеального газу
- •Основне рівняння мкт
- •Середня довжина вільного пробігу молекул
- •Вакуум. Розріджені гази
- •Лекція 9
- •Явища переносу у термодинамічно нерівноважних системах
- •Статистичні розподіли. Закон Максвелла про розподіл молекул за швидкостями теплового руху
- •Барометрична формула. Розподіл Больцмана
- •Лекція 10
- •Основи термодинаміки
- •Закон рівномірного розподілу енергії за ступенями вільності молекул
- •Внутрішня енергія, робота, теплота
- •Перший закон термодинаміки
- •Робота газу. Графічний зміст роботи
- •Теплоємність
- •Застосування першого закону термодинаміки до ізопроцесів ідеального газу
- •Адіабатний процес
- •Лекція 11
- •Коловий процес. Оборотні й необоротні процеси
- •Тепловий двигун. Цикл Карно для теплових двигунів
- •Другий закон термодинаміки
- •Поняття ентропії
- •Статистичний зміст ентропії
- •Лекція 12
- •Реальні гази. Тверді тіла
- •Сили міжмолекулярної взаємодії
- •Рівняння Ван-дер-Ваальса
- •Ізотерми реального газу
- •Внутрішня енергія реального газу
- •Тверді тіла. Моно- і полікристали
- •Типи кристалічних решіток твердих тіл
- •Дефекти у кристалах
- •Теплоємність твердих тіл
- •Фазові переходи
- •Діаграма стану
- •Список літератури Основна
- •Додаткова
- •1 Основні й похідні одиниці системи сі в молекулярній фізиці і термодинаміці
- •2 Десяткові множники та приставки
- •3 Грецький алфавіт
- •4 Латинський алфавіт
- •39600, М. Кременчук, вул. Першотравнева, 20
Статистичні розподіли. Закон Максвелла про розподіл молекул за швидкостями теплового руху
Незважаючи на повну хаотичність молекулярних рухів, розподіл молекул за швидкостями виявляється не випадковим, а цілком визначеним. Дж. Максвелл, застосовуючи статистичний метод, теоретично розв’язав задачу про розподіл молекул за швидкостями їх поступального руху. У цьому підході будемо вважати, що газ складається з великої кількості N однакових молекул, температура газу однакова у всіх частинах посудини з газом T=const й на газ не діють зовнішні сили F=0.
Якщо розбити діапазон швидкостей на
малі інтервали d,
то на кожний інтервал швидкості
припадатиме деяка кількість молекул
dN, швидкість яких лежить в інтервалі
від до +d.
Тоді dN/N визначає відносну кількість
молекул або ймовірність того, що швидкості
молекули знаходяться у цьому інтервалі
(;+d).
Функція Максвелла, або функція розподілу
молекул за швидкостями їх теплового
руху, визначає відносну кількість
молекул, яка припадає на одиничний
інтервал швидкостей:
![]() .
Застосовуючи методи теорії ймовірності,
Максвелл знайшов цю функцію у такому
вигляді:
.
Застосовуючи методи теорії ймовірності,
Максвелл знайшов цю функцію у такому
вигляді:
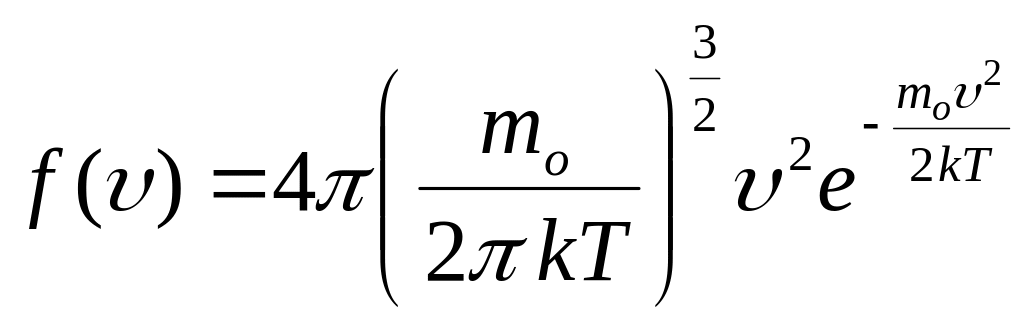 .
.
К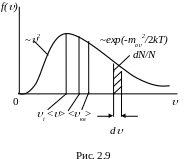 онкретний
вигляд функції Максвелла залежить від
роду газу (від маси молекули то)
і від параметра стану (від температури
Т). При малих значеннях швидкості
f()~2,
при великих – f()~exp(-mo2/2kT),
тобто прямує до нуля.
онкретний
вигляд функції Максвелла залежить від
роду газу (від маси молекули то)
і від параметра стану (від температури
Т). При малих значеннях швидкості
f()~2,
при великих – f()~exp(-mo2/2kT),
тобто прямує до нуля.
Швидкість, за якої f() максимальна, називається найімовірнішою швидкістю і. Її можна знайти з умови: df/dt = 0. Звідки:
![]() .
.
За допомогою функції Максвелла
визначається також середня арифметична
швидкість: ![]() ,
,
і середня квадратична швидкість: 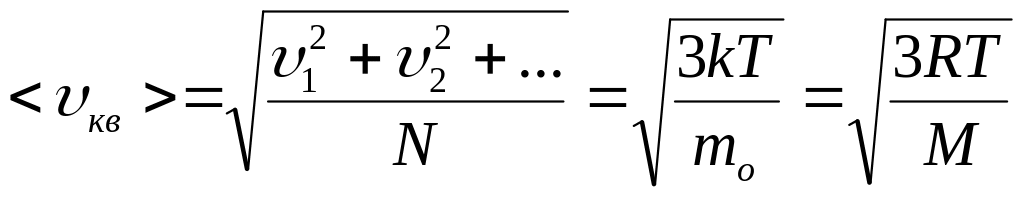 .
.
При збільшенні температури максимум
кривої f()
зміщується у бік більших швидкостей,
а його абсолютна величина fmax
зменшується (рис. 2.11). Причому площа,
яка охоплена кривою f()
і віссю Ох, залишається незмінною,
оскільки функція розподілу Максвелла
повинна задовольняти умову нормування:
![]() .
.
В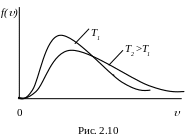 иходячи
із функції розподілу молекул за
швидкостями f(),
можна знайти функцію розподілу молекул
за кінетичними енергіями поступального
руху f().
Для цього треба від змінної
перейти до змінної =то2/2.
У результаті отримаємо функцію:
иходячи
із функції розподілу молекул за
швидкостями f(),
можна знайти функцію розподілу молекул
за кінетичними енергіями поступального
руху f().
Для цього треба від змінної
перейти до змінної =то2/2.
У результаті отримаємо функцію:
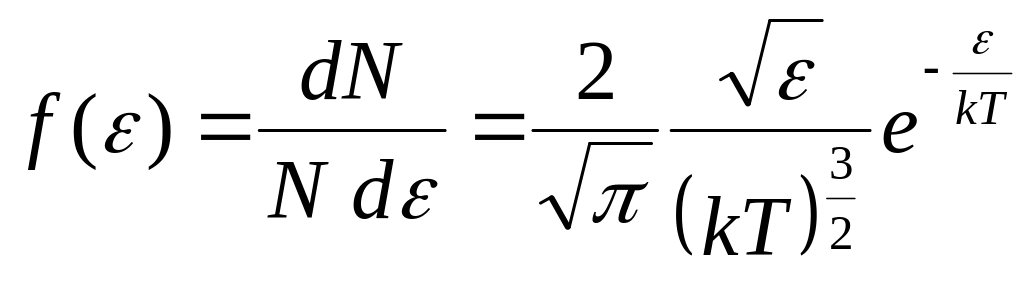 .
.
Тут dN – кількість молекул, енергія яких знаходиться в інтервалі від до +d.
Барометрична формула. Розподіл Больцмана
Я кщо
на молекули не діють зовнішні сили, то
вони рівномірно розподіляються по
всьому об'єму посудини і для них
виконується закон розподілу Максвелла.
Розглянемо тепер молекули газу, що
знаходиться у полі тяжіння Землі. Якби
не було тяжіння, то атмосферне повітря
розсіялося б у Всесвіті внаслідок
теплового руху молекул. Якби не було
теплового руху, то молекули впали б на
Землю. Тобто тяжіння і тепловий рух
приводять до деякого стаціонарного
стану газу, при якому його тиск і
концентрація зменшуються з висотою.
кщо
на молекули не діють зовнішні сили, то
вони рівномірно розподіляються по
всьому об'єму посудини і для них
виконується закон розподілу Максвелла.
Розглянемо тепер молекули газу, що
знаходиться у полі тяжіння Землі. Якби
не було тяжіння, то атмосферне повітря
розсіялося б у Всесвіті внаслідок
теплового руху молекул. Якби не було
теплового руху, то молекули впали б на
Землю. Тобто тяжіння і тепловий рух
приводять до деякого стаціонарного
стану газу, при якому його тиск і
концентрація зменшуються з висотою.
Будемо розглядати ідеальний газ, який знаходиться в однорідному полі тяжіння і температура якого постійна Т=const, тобто не змінюється з висотою. Якщо тиск газу на висоті h дорівнює Р, то на висоті h+dh він дорівнює P+dP (рис. 2.11), причому при dh>0 dP<0, оскільки тиск з висотою зменшується.
Згідно із законом Паскаля (див. п. 1.7.1), різниця тисків Р i P+dP дорівнює гідростатичному тиску стовпа газу висотою dh, тобто:
Р – (P+dP) = gdh,
де – густина газу на висоті h.
Використавши рівняння Менделєєва–Клапейрона, PV = mRT/M, виразимо густину =m/V=PM/RT, звідки:
dР = –![]() ,
або
,
або
![]() .
.
Уважаючи Т=const й інтегруючи за тиском від Po до P, а за висотою від 0 до h, отримуємо:
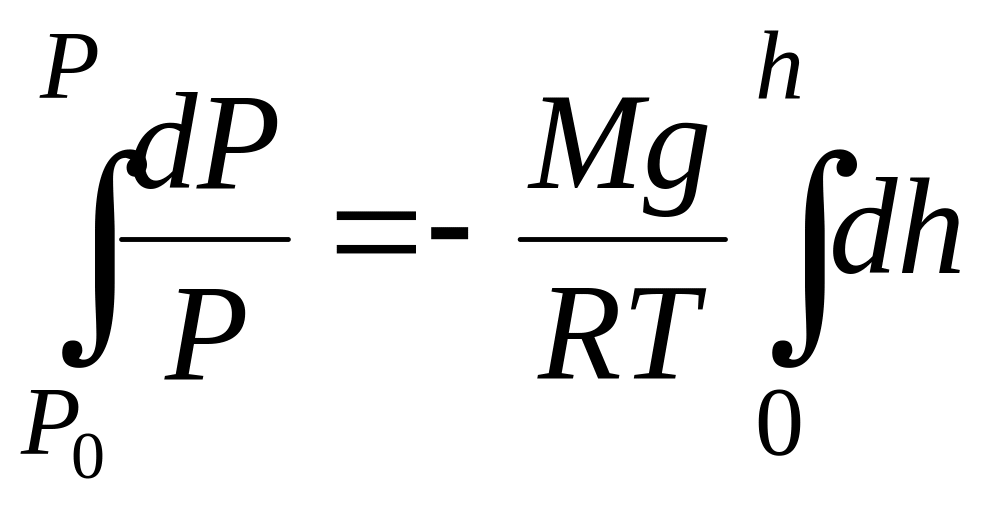 ,
,
![]() ,
,
звідси
![]() .
.
Цей вираз називається барометричною формулою, а формула для визначення висоти за зміною тиску
![]()
н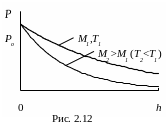 азивається
альтиметричною формулою.
азивається
альтиметричною формулою.
З цих формул можна зробити висновок, що тиск газу зменшується із висотою експоненціально (рис. 2.12) і тим швидше, чим більша молярна маса М газу і чим нижча температура Т.
Барометрична формула дає можливість також визначити залежність концентрації газу від висоти. З рівняння стану ідеального газу у вигляді P=nkT при Т=const отримуємо
![]() ,
,
де no – концентрація молекул на висоті h = 0.
Оскільки M = moNA, R = k moNA, то
![]() ,
,
де Wn = mogh – потенціальна енергія молекули у полі тяжіння.
Із збільшенням висоти концентрація молекул зменшується за експоненціальним законом. При зменшенні температури Т0 концентрація n0, тобто всі молекули опускаються на дно посудини.
Больцман довів, що це співвідношення вірне не тільки для поля тяжіння, але і для інших потенціальних полів, якщо маси молекул однакові і вони знаходяться у стані теплового хаотичного руху. Тому цей вираз
![]()
називається розподілом Больцмана для частинок у зовнішньому потенціальному полі.
