
- •Лекції з фізики основи молекулярної фізики і термодинаміки
- •Лекція 8
- •Основи молекулярної фізики і термодинаміки
- •Молекулярно-кінетична теорія ідеального газу
- •Основні положення молекулярно-кінетичної теорії
- •Статистичний і термодинамічний методи
- •Макроскопічні параметри стану речовини
- •Ідеальний газ. Дослідні закони ідеального газу
- •Рівняння стану ідеального газу
- •Основне рівняння мкт
- •Середня довжина вільного пробігу молекул
- •Вакуум. Розріджені гази
- •Лекція 9
- •Явища переносу у термодинамічно нерівноважних системах
- •Статистичні розподіли. Закон Максвелла про розподіл молекул за швидкостями теплового руху
- •Барометрична формула. Розподіл Больцмана
- •Лекція 10
- •Основи термодинаміки
- •Закон рівномірного розподілу енергії за ступенями вільності молекул
- •Внутрішня енергія, робота, теплота
- •Перший закон термодинаміки
- •Робота газу. Графічний зміст роботи
- •Теплоємність
- •Застосування першого закону термодинаміки до ізопроцесів ідеального газу
- •Адіабатний процес
- •Лекція 11
- •Коловий процес. Оборотні й необоротні процеси
- •Тепловий двигун. Цикл Карно для теплових двигунів
- •Другий закон термодинаміки
- •Поняття ентропії
- •Статистичний зміст ентропії
- •Лекція 12
- •Реальні гази. Тверді тіла
- •Сили міжмолекулярної взаємодії
- •Рівняння Ван-дер-Ваальса
- •Ізотерми реального газу
- •Внутрішня енергія реального газу
- •Тверді тіла. Моно- і полікристали
- •Типи кристалічних решіток твердих тіл
- •Дефекти у кристалах
- •Теплоємність твердих тіл
- •Фазові переходи
- •Діаграма стану
- •Список літератури Основна
- •Додаткова
- •1 Основні й похідні одиниці системи сі в молекулярній фізиці і термодинаміці
- •2 Десяткові множники та приставки
- •3 Грецький алфавіт
- •4 Латинський алфавіт
- •39600, М. Кременчук, вул. Першотравнева, 20
Макроскопічні параметри стану речовини
Система макроскопічних тіл, які взаємодіють між собою та навколишнім середовищем, обмінюючись, зокрема, енергією, називається термодинамічною системою. Стан системи характеризується макроскопічними фізичними величинами, які називаються термодинамічними параметрами стану. До основних параметрів стану належать, насамперед, тиск Р, об’єм V, термодинамічна температура Т, густина речовини , молярна маса М.
Тиском називається величина нормальної
складової сили, що діє на одиницю площі
поверхні, до якої ця сила прикладена:
![]() .
.
Температура характеризує тепловий стан речовини і відображує рівень інтенсивності хаотичного руху частинок (молекул), з яких складається тіло. Температура – це характеристика системи, яка знаходиться у стані термодинамічної рівноваги, тобто температура має бути однаковою у всіх тіл, що входять до системи. Рівномірна температурна шкала звичайно побудована на двох реперних точках відліку, різниці між якими надають визначене значення. У шкалі Цельсія за нуль відліку взято температуру замерзання води при атмосферному тиску, а за одиницю виміру 1С, який дорівнює 1/100 різниці між температурами замерзання і кипіння води при атмосферному тиску. У термодинамічній шкалі Кельвіна за нуль узято температуру абсолютного нуля, коли припиняється тепловий рух молекул, і яка дорівнює -273,15С, а одиниця виміру 1 К = 1С. Отже, значення температури за шкалами Кельвіна і Цельсія пов’язані між собою співвідношенням: Т[К] = tС + 273,15С.
Густина – це маса одиниці об’єму
речовини:
![]() .
.
1 моль речовини – це одиниця її кількості,
яка містить стільки ж структурних
частинок, скільки атомів міститься у
0,012 кг вуглецю (точніше, його ізотопу
![]() ).
Це – число Авогадро – NА
= 6,021023 1/моль.
Молярна маса речовини – маса одного
моля – знаходиться за формулою:
).
Це – число Авогадро – NА
= 6,021023 1/моль.
Молярна маса речовини – маса одного
моля – знаходиться за формулою:
М = (А1 n1 +А2 n2 +…)10-3 кг/моль,
де А1 , А2 , … – відносні атомні маси хімічних елементів, з яких побудована молекула;
n1, n2, … – кількість відповідних атомів у молекулі.
Тоді кількість речовини у молях
визначається за формулою:
![]() .
.
Найважливіші параметри стану P, V, T пов’язані між собою рівнянням f (P, V,T) = 0, яке називається рівнянням стану.
Ідеальний газ. Дослідні закони ідеального газу
У молекулярно-кінетичній теорії користуються моделлю ідеального газу, яка відповідає таким умовам:
власний об’єм молекул газу нехтовно малий порівняно з об’ємом посудини;
між молекулами газу відсутні сили взаємодії;
зіткнення молекул газу між собою і стінками посудини абсолютно пружні.
Модель ідеального газу можна використовувати при вивченні реальних газів, оскільки вони за умов, близьких до нормальних (Р =РА, Т = 273 К), а також при низьких тисках і високих температурах близькі за своїми властивостями до ідеального газу.
Розглянемо деякі термодинамічні ізопроцеси, у яких відбувається зміна термодинамічних параметрів, що визначають стан газу. Ізопроцесом називається процес, у якому один з параметрів стану (P, V або T) залишається постійним, а інші змінюються.
П роцес,
який протікає у газі, коли температура
залишається постійною (Т = const),
називається ізотермічним процесом.
Для такого процесу виконується закон
Бойля-Маріотта: для даної
маси газу (т = const) при постійній
температурі добуток тиску газу на його
об'єм є величиною постійною:
роцес,
який протікає у газі, коли температура
залишається постійною (Т = const),
називається ізотермічним процесом.
Для такого процесу виконується закон
Бойля-Маріотта: для даної
маси газу (т = const) при постійній
температурі добуток тиску газу на його
об'єм є величиною постійною:
PV = const, або
![]() .
.
Тобто при постійній температурі тиск газу зменшується обернено пропорційно зростанню температури. Діаграма цього ізопроцесу в координатах P-V є гіперболою (рис. 2.1).
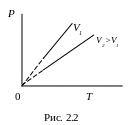
Процес, який протікає у газі, коли об’єм залишається постійним (V = const), називається ізохорним процесом. Для такого процесу виконується закон Шарля: для даної маси газу (т = const) при постійному об’ємі відношення тиску газу до його температури є величиною постійною:
![]()
 ,
або
,
або
![]() .
.
Тобто тиск газу, який знаходиться у замкнутому об’ємі, зростає прямо пропорційно зростанню термодинамічної температури. Діаграма цього ізопроцесу у координатах P-T є прямою лінією (рис. 2.2).
П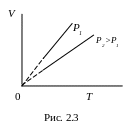 роцес,
який протікає у газі, коли тиск залишається
постійним (Р = const), називається
ізобарним процесом. Для такого
процесу виконується закон
Гей-люсака: для даної маси газу
(т = const) при постійному тиску
відношення об’єму газу до його температури
є величиною постійною:
роцес,
який протікає у газі, коли тиск залишається
постійним (Р = const), називається
ізобарним процесом. Для такого
процесу виконується закон
Гей-люсака: для даної маси газу
(т = const) при постійному тиску
відношення об’єму газу до його температури
є величиною постійною:
![]() ,
або
,
або
![]() .
.
Тобто об’єм газу при постійному тиску зростає прямо пропорційно зростанню термодинамічної температури. Діаграма цього ізопроцесу у координатах V-T є прямою лінією (рис. 2.3).
Закон Авогадро: молі будь-яких газів при однакових температурі й тиску займають однакові об’єми. За нормальних умов (P = PА = 1,03105 Па, T = 273 К) молярний об’єм Vm дорівнює 22,410-3 м3/моль.
Закон Дальтона: тиск суміші ідеальних газів дорівнює сумі парціальних тисків газів, з яких вона складається:
![]() .
.
Парціальний тиск – це тиск газу, який входить до суміші, в об’ємі цієї суміші.
