
- •© Зимон а.Д., , Евтушенко а.М., Крашенинникова и.Г. Учебно-практическое пособие. – м., мгуту, 2004.
- •Свойства дисперсных систем
- •Оптические свойства дисперсных систем
- •8.1. Оптические свойства высокодисперсных систем
- •8.2. Оптическая плотность (экстинкция)
- •Молекулярно-кинетические свойства высокодисперсных систем
- •9.1. Причина молекулярно-кинетических свойств
- •9.2. Броуновское движение
- •9.3. Диффузия
- •9.4. Осмос
- •Устойчивость дисперсных систем
- •10.1. Проблема устойчивости дисперсных систем
- •10.2. Седиментационная устойчивость
- •10.3. Кинетика коагуляции
- •10.4. Термодинамические основы и факторы устойчивости дисперсных систем
- •10.5. Расклинивающее давление и теория длфо
- •10.6. Расклинивающее давление и агрегативная устойчивость
- •10.7. Изменение агрегативной устойчивости при помощи электролитов
- •10.8. Особенности агрегативной устойчивости лиофобных дисперсных систем и структурно-механический барьер
- •Структурно-механические свойства дисперсных систем
- •11.1. Образование, особенности и разрушение структурированных систем
- •11.2. Прочность и вязкость дисперсных систем
- •Получение и очистка дисперсных систем
- •12.1. Классификация способов получения дисперсных систем
- •(В скобках указан вид систем)
- •12.2. Диспергирование
- •12. 3. Получение дисперсных систем за счет конденсационных процессов
- •12.4. Мембраны и мембранные процессы
- •12.5. Мембранная технология и ее применение в промышленности
- •Тесты для самостоятельной проработки
- •Ответы на тесты для самостоятельной проработки
- •Вопросы для самоконтроля
- •Список литературы
- •Физическая и коллоидная химия.
- •Коллоидная химия
- •Раздел второй
- •Учебно-практическое пособие
9.4. Осмос
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей, выравнивающий концентрацию. Этот процесс называется осмосом.
О смос
характерен не только для истинных, но
и для коллоидных растворов. Схема осмоса
приведена на рис. 9.4. В сосуд, имеющий
полупроницаемую перегородку 3,
помещен истинный или коллоидный раствор
1.
Полупроницаемая перегородка способна
пропускать дисперсионную среду или
растворитель, но является препятствием
для коллоидных частиц или растворенных
веществ. С наружной стороны перегородки
находится чистая жидкость (растворитель)
2.
Концентрация раствора по обе стороны
полупроницаемой перегородки будет
различной. Внутри сосуда 1
часть раствора занимают молекулы
растворенного вещества или частицы
дисперсной фазы, поэтому концентрация
жидкости (растворителя или дисперсионная
среда) там будет меньше, чем в емкости
2
с чистой жидкостью.
смос
характерен не только для истинных, но
и для коллоидных растворов. Схема осмоса
приведена на рис. 9.4. В сосуд, имеющий
полупроницаемую перегородку 3,
помещен истинный или коллоидный раствор
1.
Полупроницаемая перегородка способна
пропускать дисперсионную среду или
растворитель, но является препятствием
для коллоидных частиц или растворенных
веществ. С наружной стороны перегородки
находится чистая жидкость (растворитель)
2.
Концентрация раствора по обе стороны
полупроницаемой перегородки будет
различной. Внутри сосуда 1
часть раствора занимают молекулы
растворенного вещества или частицы
дисперсной фазы, поэтому концентрация
жидкости (растворителя или дисперсионная
среда) там будет меньше, чем в емкости
2
с чистой жидкостью.
З
Рис.
9.4. Схема
осмоса:
1 — сосуд с
истинным или коллоидным раствором; 2
— емкость с чистой жидкостью
(растворителем); 3 — полупроницаемая
перегородка (мембрана)
Существует еще и термодинамическое объяснение осмотического переноса. Химический потенциал чистой жидкости m2 превышает химический потенциал этой же жидкости в растворе μ1. Процесс идет самопроизвольно в сторону меньшего химического потенциала до тех пор, пока не произойдет выравнивание химических потенциалов, т.е. до достижения условия μ2 = μ2.
В результате перемещения жидкости в емкости 1 создается избыточное давление p, называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н, что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя. Дальнейшего изменения уровня уже не произойдет, а вес столба жидкости над уровнем растворителя будет служить мерой осмотического давления.
Осмотическое давление возникает при движении чистого растворителя в сторону раствора или от более разбавленного раствора в сторону более концентрированного, а следовательно, связано с разностью концентраций растворенного вещества и растворителя. Осмотическое давление — это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану.
Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор). Осмотическое давление не есть проявление какого-либо внешнего воздействия. Оно возникает самопроизвольно, как следствие молекулярно-кинетических свойств дисперсионной среды.
Высота подъема жидкости Н над первоначальным положением раствора количественно определяет осмотическое давление, которое обычно обозначают через π.
Для чистого растворителя и идеального раствора неэлектролитов осмотическое давление выразится формулой
πV = RT In(1–x), (9.8, а)
где V — молярный объем растворителя; х — молярная доля растворенного вещества.
В случае разбавленных растворов неэлектролитов, когда x << 1, можно записать следующее уравнение:
πV = nRT. (9.9)
Согласно определению осмотическое давление можно найти из уравнения состояния (9.9), где n — число молей растворенного вещества.
Если масса растворенного вещества равна q, а молекулярная его масса М, то n = q/М; тогда согласно уравнению (9.9) осмотическое давление равно
![]() (9.10)
(9.10)
Величина q/V есть массовая концентрация растворенного вещества, поэтому осмотическое давление можно определить при помощи следующей формулы
π = (vм / M)RT. (9.11)
Формула (9.11) является основной для определения осмотического давления. Она позволяет найти зависимость осмотического давления от размеров частиц растворенного вещества. Для этой цели массу дисперсной фазы можно представить в виде
M = mNA, m = (4 / 3)πr3ρ, (9.12)
где m, r — молекулярная масса и радиус частиц дисперсной фазы; ρ — плотность материала частиц.
Подставив в уравнение (9.11) значение М из формулы (9.12), получим
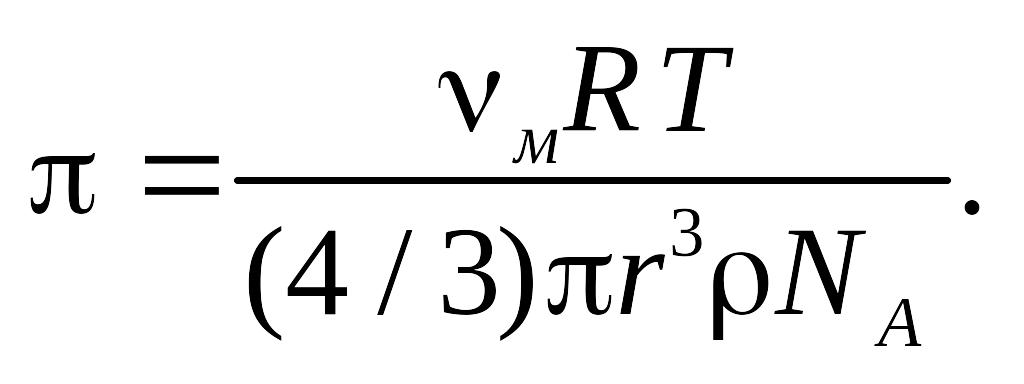 (9.13)
(9.13)
Формулу (9.13) используют для определения осмотического давления коллоидных растворов.
Осмотическое давление коллоидных растворов (высокодисперсных систем с жидкой дисперсионной средой) незначительно и составляет всего 1 мм водяного столба или даже меньше (1 мм водяного столба равен примерно 10 Па). Размеры и концентрация частиц в результате агрегации и других процессов могут изменяться. В связи с этим осмотическое давление для высокодисперсных систем непостоянно.
Из формулы (9.13) следует, что осмотическое давление прямо пропорционально концентрации дисперсной фазы и обратно пропорционально размеру частиц этой фазы в третьей степени. Чем меньше размер частиц, тем значительнее осмотическое давление. Если, например, для коллоидных растворов диаметр частиц составляет 100 нм, а размер молекул растворенного вещества — 1 нм, то осмотическое давление молекулярных растворов по сравнению с коллоидными будет в 106 раз больше. Осмотическое давление истинных растворов значительно превышает осмотическое давление коллоидных растворов и составляет для сока сахарной свеклы 35∙105 Па, экстракта кофе — 25∙105 Па, фруктовых соков — 1,5∙105 Па, 6%-го раствора сахара — 60∙105 Па.
Таким образом, осмос, как и все молекулярно-кинетические свойства, характерен для высокодисперсных систем, размеры частиц дисперсной фазы которых не превышают 0,1 мкм.
Упражнения
1. Определить средний сдвиг капель эмульсии радиусом 10 нм за время τ = 4 с при 293 К и вязкости η = 10–3 Па∙с.
Воспользуемся формулой (9.3):
![]()
2. Мыло образует в воде мицеллы, радиус которых равен 12,5 нм. Определите коэффициент диффузии мицелл при 313 К, если вязкость раствора равна 6,5∙ 10–4 Па∙с.
По формуле (9.7) находим
![]()
3. Определить размеры частиц яичного альбумина, находящихся в воде при 293 К, если коэффициент диффузии D = 7,8∙10–11 м2/с, а вязкость воды равна 10–3 Па∙ с.
По формуле (9.8) находим
![]()
4. Во сколько раз осмотическое давление раствора сока сахарной свеклы π1 молекулы которого имеют диаметр d1 = 0,8 нм, превышает осмотическое давление коллоидного раствора свекловичного сока π2, с диаметром частиц d2 = 80 нм? Концентрацию коллоидного и молекулярного растворов и их плотности считать одними и теми же.
Согласно формуле (9.13)
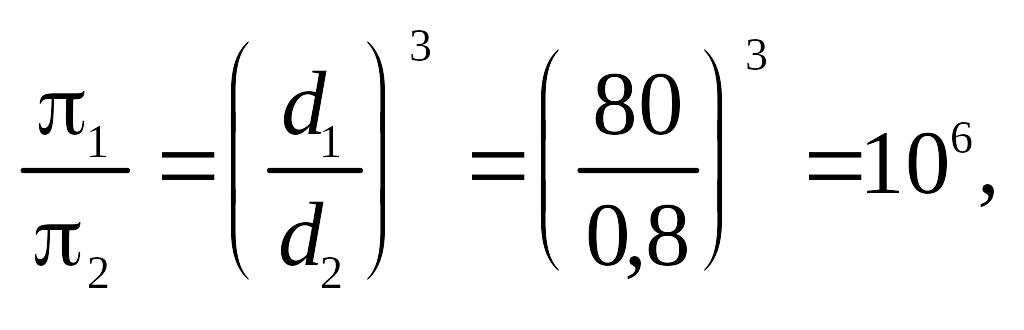
т.е. осмотическое давление молекулярного раствора в 106 раз больше осмотического давления коллоидного раствора.
5. Определить осмотическое давление пыли при 293 К, если ее концентрация 1,5∙10–2 кг/м2, средний радиус частиц 40 мкм, плотность 1,3∙ 103 кг/м3.
На основании формулы (9.13) находим
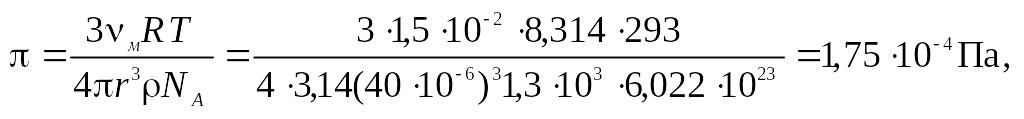
т.е. осмотическое давление незначительно.
Г л а в а 10
