
- •© Зимон а.Д., , Евтушенко а.М., Крашенинникова и.Г. Учебно-практическое пособие. – м., мгуту, 2004.
- •Свойства дисперсных систем
- •Оптические свойства дисперсных систем
- •8.1. Оптические свойства высокодисперсных систем
- •8.2. Оптическая плотность (экстинкция)
- •Молекулярно-кинетические свойства высокодисперсных систем
- •9.1. Причина молекулярно-кинетических свойств
- •9.2. Броуновское движение
- •9.3. Диффузия
- •9.4. Осмос
- •Устойчивость дисперсных систем
- •10.1. Проблема устойчивости дисперсных систем
- •10.2. Седиментационная устойчивость
- •10.3. Кинетика коагуляции
- •10.4. Термодинамические основы и факторы устойчивости дисперсных систем
- •10.5. Расклинивающее давление и теория длфо
- •10.6. Расклинивающее давление и агрегативная устойчивость
- •10.7. Изменение агрегативной устойчивости при помощи электролитов
- •10.8. Особенности агрегативной устойчивости лиофобных дисперсных систем и структурно-механический барьер
- •Структурно-механические свойства дисперсных систем
- •11.1. Образование, особенности и разрушение структурированных систем
- •11.2. Прочность и вязкость дисперсных систем
- •Получение и очистка дисперсных систем
- •12.1. Классификация способов получения дисперсных систем
- •(В скобках указан вид систем)
- •12.2. Диспергирование
- •12. 3. Получение дисперсных систем за счет конденсационных процессов
- •12.4. Мембраны и мембранные процессы
- •12.5. Мембранная технология и ее применение в промышленности
- •Тесты для самостоятельной проработки
- •Ответы на тесты для самостоятельной проработки
- •Вопросы для самоконтроля
- •Список литературы
- •Физическая и коллоидная химия.
- •Коллоидная химия
- •Раздел второй
- •Учебно-практическое пособие
9.3. Диффузия
Диффузией называют самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. Различают следующие виды диффузии: молекулярную, ионную и коллоидных частиц.
Диффузия высокодисперсных коллоидных частиц схематически показана на рис. 9.3. В нижней части концентрация частиц больше, чем в верхней, т.е. v1 > v2*. Диффузия идет из области с большей концентрации в область с меньшей, т.е. снизу вверх; направление диффузии на рис. 9.3 показано стрелкой. Диффузия характеризуется определенной скоростью перемещения вещества через поперечное сечение В, которая равна dm/dτ.
На
расстоянии Δх
разность концентраций составит v2
– v1,
так как v2
< v1,
то эта величина отрицательна. Изменение
концентрации, отнесенное к единице
расстояния, называют градиентом
концентрации. Градиент концентрации
равен (v2
– v1)/Δx,
или в д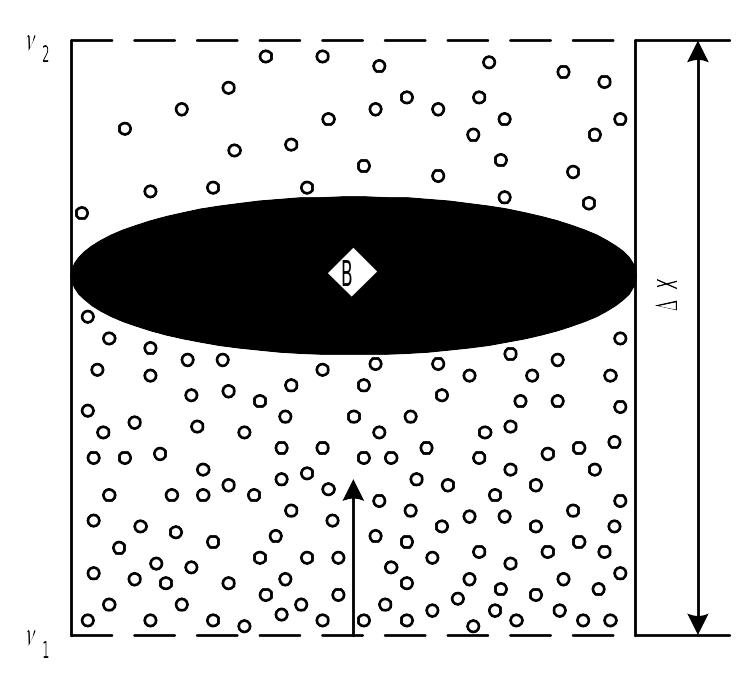 ифференциальной
форме, dv/dx.
ифференциальной
форме, dv/dx.
Скорость перемещения вещества пропорциональна градиенту концентрации и площади В, через которую происходит движение диффузионного потока, т.е.
![]() (9.4)
(9.4)
Скорость диффузии (dm/dt) величина положительная, а градиент концентрации (dv/dx) — отрицателен; по этой причине перед правой частью уравнения (9.4) ставится знак минус.
К
Рис.
9.3. Диффузия
частиц в дисперсной системе
Для стационарного процесса градиент концентрации постоянен, т.е. dv/dx = const. Значительное число диффузионных процессов близко к стационарным. Интегрируя уравнение (9.4), получим
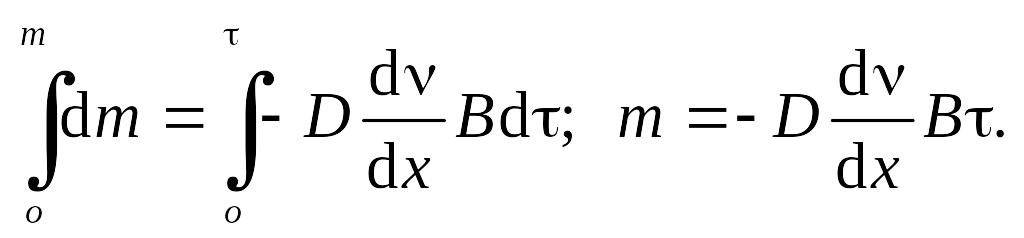 (9.5)
(9.5)
Формула (9.5) характеризует первый закон диффузии Фика. Из этой формулы нетрудно определить физический смысл коэффициента диффузии. Если –dv/dх = 1, В = 1 и τ = 1, то m = D, т.е. коэффициент диффузии численно равен массе диффундирующего вещества, когда градиент концентрации, площадь сечения диффузионного потока и время равны единице. Следует говорить лишь о численном равенстве, так как размерность коэффициента диффузии [м2/с] не соответствует размерности массы.
В случае нестационарного процесса градиент концентрации не является постоянной величиной, т.е. dv/dx ≠ const. Интегрирование уравнения (9.4) усложняется, а форма расчетного уравнения учитывает изменение градиента концентрации.
Значения коэффициента диффузии для различных ее видов приведены ниже:
Вид диффузии |
Ионная |
Молекулярная |
Коллоидных частиц |
Коэффициент диффузии, м2/с |
10–8 |
10-9 |
10–10 |
Коллоидные частицы характеризуются минимальным коэффициентом диффузии. Это означает, что диффузия коллоидных частиц более затруднена по сравнению с молекулярной и ионной. Так, например, скорость диффузии частиц карамели, дисперсной фазой которой является коллоидный раствор, в 100—1000 раз меньше скорости диффузии молекул сахара, формирующих молекулярный раствор. В газах коэффициент диффузии увеличивается до 10–4, а в твердых телах снижается до 10–12 м2/с.
Количественно диффузия определяется коэффициентом диффузии, который связан со средним сдвигом, следующим соотношением:
![]() (9.6)
(9.6)
Диффузия высокодисперсных частиц совершается беспорядочно с большей вероятностью в сторону меньшей концентрации. Время, определяемое соотношением (9.6), характеризует продолжительность диффузии. Чем меньше коэффициент диффузии, тем продолжительнее процесс диффузии.
При выводе уравнения (9.6) были приняты следующие допущения: частицы дисперсных систем движутся независимо друг от друга и между ними отсутствует взаимодействие; средняя энергия поступательных движений частиц равна 0,5 kT.
Используя формулу (9.3) для определения среднего сдвига, коэффициент диффузии можно представить в виде
![]() (9.7)
(9.7)
где k — константа Больцмана, равная R/NA.
Если коэффициент диффузии известен, то по формуле (9.7) можно определить размер частиц:
![]() (9.8)
(9.8)
Как следует из формулы (9.7), чем больше размер частиц, тем меньше коэффициент диффузии и менее интенсивна сама диффузия.
Формулы (9.6)—(9.8) позволили экспериментальным путем определить константу Больцмана и число Авогадро.
В воздухе коэффициент диффузии частиц радиусом 1 нм составляет 1,28 ∙ 10–6 м2/с. Для частиц радиусом 100 нм коэффициент диффузии снижается до 2,21 ∙ 10–10 м2/с, для частиц радиусом 10 мкм — до 1,38 ∙10–10 м2/с. Для частиц, размер которых превышает 10 мкм, т.е. для грубодисперсных систем, коэффициент диффузии и сама диффузия ничтожны.
Диффузия в полной мере проявляется у высокодисперсных систем, ослаблена у среднедисперсных и практически отсутствует у грубодисперсных систем.
Коэффициент диффузии зависит и от формы частиц, что не учитывается в уравнении (9.7). Поэтому при помощи формулы (9.8) можно определить размер только коллоидных шарообразных частиц или приведенный к шарообразному размеру частиц неправильной формы.
Таким образом, диффузия непосредственно связана с броуновским движением; эта связь количественно выражается при помощи уравнений (9.6)—(9.8).
