
- •1. Предмет та значення органічної хімії.
- •2. Етапи становлення органічної хімії. Основні положення теорії хімічної будови органічних сполук о.М.Бутлерова та її значення для розвитку органічної хімії.
- •3. Способи зображення органічних молекул (самостійно).
- •4. Класифікація органічних сполук за будовою вуглецевого скелету і природою функціональної групи (самостійно).
- •5. Номенклатурні системи в органічній хімії – тривіальна, раціональна та міжнародна (iupac) (радикально-функціональна і замісникові).
- •6. Структурна ізомерія органічних сполук: ізомерія вуглецевого скелету, ізомерія положення, ізомерія функціональної групи. Правила виведення ізомерів. Поняття про таутомерію.
- •7. Типи хімічних зв’язків в органічних молекулах (йонний, ковалентний, координаційний, семіполярний і водневий); їх вплив на властивості речовини. Властивості ковалентного зв’язку.
6. Структурна ізомерія органічних сполук: ізомерія вуглецевого скелету, ізомерія положення, ізомерія функціональної групи. Правила виведення ізомерів. Поняття про таутомерію.
Статична структурна ізомерія – це ізомерія речовин, яка пов’язана з певною послідовністю сполучення атомів між собою в молекулах і при якій ізомери не перетворюються самовільно один в одного.
Правила виведення ізомерів
1. Перший ізомер має в ланцюгу найбільшу кількість атомів Карбону.
2. Другий ізомер має в ланцюгу на один атом Карбону менше. Пам’ятайте, алкільні радикали не можна ставити біля першого і останнього атомів Карбону основного ланцюга. Алкільні радикали розміщують тільки біля нерівноцінних атомів Карбону.
3. При заданій кількості атомів Карбону проводять переміщення функціональних груп.
4. Надалі знову зменшують кількість атомів Карбону в основному ланцюгу на один. Пам’ятайте, радикали етил і інші не можна ставити біля другого і передостаннього атомів Карбону основного ланцюга.
5. Різні ізомери повинні мати різну хімічну назву (при цьому слід дотримуватись правил замісникової номенклатури).
Таутомерія – динамічна структурна ізомерія, яка пов’язана з оборотним перенесенням атомів у вигляді катіона або аніона від однієї молекули до іншої. Найчастіше відбувається перенесення протона Н+ і тому таку таутомерію називають прототропною. До неї належить таутомерія, що пов’язана з підвищеною рухливістю атома Гідрогену в -положенні до електроноакцепторних груп.
Види таутомерії:
1) Кето-енольна
2) Нітро-аци-нітро таутомерія
3) Лактим-лактамна таутомерія
4) Азольна таутомерія
5) Імін-енамінна таутомерія
6) Нітрозо-оксимна таутомерія
7. Типи хімічних зв’язків в органічних молекулах (йонний, ковалентний, координаційний, семіполярний і водневий); їх вплив на властивості речовини. Властивості ковалентного зв’язку.
Одне з головних питань – питання про хімічний зв’язок. Це питання було розв’язане тільки після відкриття електрону. На початку XX ст., коли були досягнуті успіхи в питанні будови електронних оболонок атомів, коли стало відомо, що властивості атомів визначаються переважно електронами останнього енергетичного рівня, питання про хімічний зв’язок набрало ваги. Розробка електронних уявлень в органічній хімії (Штарк, Коссель, Льюїс, Ленгмюр) приводить до виникнення “октетної теорії”, або “теорії електронних пар” (1916-1917 р.) для практикування природи хімічного зв’язку. Автори звернули увагу на стабільність конфігурації з 8 електронів (інертні гази) і на те, що при утворенні зв’язку атоми намагаються утворити стійкий октет.
формули Льюїса
У відповідності з октетною теорією утворення октету може проходити двома шляхами, тому є два види хімічного зв’язку: гетерополярний і гомеополярний зв’язки.
1. Гетерополярний, електровалентний (Коссель, Ленгмюр) або іонна взаємодія пов’язана з повною віддачею атомами електронів. Атоми перетворюються в іони.
2. Гомеополярний зв’язок, атомний. Стійкі октети створюються шляхом узагальнення електронів. Зв’язок створений спільними електронними парами, називається ковалентним. Виникнення ковалентного зв’язку йде двома механізмами:
а) коллігація (обмінний механізм), кожний з атомів дає електрони для спільного користування):
СН3 + СН3 СН3 – СН3
б) координація (донорно-акцепторний механізм) – один з атомів є донором електронів, а другий – акцептором.
|
|
|
|
|
|
|
|
|
|
|
СН3 + СН3 СН3 – СН3
Ці два методи – це два різних шляхи утворення одного і того ж зв’язку, структура якого не залежить від механізму утворення. По донорно-акцепторному механізму взаємодіють сполуки, які містять в своєму складі атоми N, O, S.
хлорид метиламонію

Льюїс розглядає подібні реакції як кислотно-основні. Донори – основи, акцептори – кислоти.
Семиполярний зв’язок (біполярний, півполярний) – це різновидність ковалентного зв’язку, утвореного по донорно-акцепторному механізму. Це такий зв’язок, коли ковалентнозв’язані атоми несуть повні протилежні (формальні) заряди.
Цей вид зв’язку являє собою комбінацію ковалентного і електровалентного зв’язку. Від звичайного ковалентного зв’язку відрізняється тим, що атоми несуть заряди; від електроновалентного тим, що крім іонної взаємодії атоми зв’язані ще й ковалентно, тому сполуки не дисоціюють у водному розчині на іони.
Водневий зв’язок
Причина – утворення водневих зв’язків.
Водневий зв’язок відноситься до особливого типу донорно-акцепторного зв’язку. Водневий зв’язок виникає у випадку, коли водень зв’язаний ковалентно з сильно електронегативним елементом (F, O, N). Електронна пара при цьому значно зміщена до ен атому, а над воднем виникає +. При наближенні до атома водню іншого електронегативного атома іншої молекули, виникають сили взаємодії. При цьому ен атом виступає в якості донора електронів, а водень – в якості акцептора.
Атом водню займає проміжне положення між двома атомами, з одним з яких він зв’язаний ковалентно. Водневий зв’язок буває міжмолекулярним і внутрішньомолекулярним.
Утворення міжмолекулярного зв’язку у випадку води, спиртів, приводить до збільшення Тк. Інколи зв’язки дуже міцні, утворюються асоціати:
|
|
|
|
n – нітрофенол (не переганяються з водяним паром)
о-нітрофенол (внутрішньо-молекулярні зв’язки) переганяється з водяною парою.
Розчинність нижчих спиртів і амінів пов’язана з їх здатністю утворювати водневі зв’язки.
Водневі зв’язки дуже поширені в природі, вони позначаються га властивостях білків, нуклеїнових кислот. Функціональні властивості білків визначаються їх здатністю утворювати водневі зв’язки.
Ген-фрагмент ДНК – складна молекула, яка повинна зберегти свою конфігурацію, щоб вірно передавати спадковість. Водневі зв’язки відіграють важливу роль в підтриманні цієї конфігурації. Відомо, що з усіх взаємодій лише водневі зв’язки мають потрібну міцність і направленість, які характеризуються необхідними для підтримання структур молекул.
Деякі властивості ковалентних зв’язків
Ковалентний зв’язок характеризується довжиною, енергією, полярністю, поляризованістю, насиченістю і направленістю. Дві останні властивості відсутні при іонній взаємодії.
Довжина зв’язку (l) – віддаль між ядрами атомів, що відповідає мінімальній енергії системи з двох ядер. 10А0 – 1нм.
Сsp3 – Сsp3 0,154 нм, Сsp3 – Сsp2 0,150 нм Сsp3 – Сsp3 0,146 нм
С = С 0,134 нм С С 0,120 нм С – Н 0,111 нм
Енергія зв’язку (Е) – є мірою його міцності і визначається як кількість енергії, що виділяється при утворенні зв’язку, або яку потрібно затратити на його розрив. Виражається в кДж/моль 1 ккал = 4,184 кДж.
С – С 330 - 360 кДж/моль, С = С 590 - 640 кДж/моль,
С С 810 - 840 кДж/моль, С – Н 402 - 455 кДж/моль.
Просторова направленість sp3 – гібридизація тетраедрична будова
sp2 – гібридизація площинна будова
sp – гібридизація лінійна будова
Полярність зв’язку (статична поляризація) відбиває взаємний вплив безпосередньо зв’язаних атомів. Це зміщення електронної хмари зв’язку до більш електронегативного атома.
Електронегативність – здатність атома або групи атомів відтягувати до себе електронну густину. Електронегативність елементів визначається шкалою Полінга:
4,0 3,5 3,2 3,0 2,8 2,75 2,6 2,5 2,2
F > O > Csp > N, Cl > Br > Csp2 > I > Csp3 > H
Чим більша електронегативність атома, тим більш полярний зв’язок.
Кількісно полярний зв’язок можна охарактеризувати величиною дипольного моменту (). Полярні молекули утворюють диполі. Диполь – система з розділеними центрами електропозитивних і електронегативних зарядів. Одиниці виміру дипольного моменту Д (дебай) або Кулон метр (Кл м).
= g l
1 Д = 3,33 10–30 Кл м. Для ковалентних молекул = 0 – 4 Д, для йонних – = 4 – 11 Д.
Дипольний момент – величина векторна, показується від + до – .
В молекулі дипольний момент являє собою геометричну суму дипольних моментів окремих зв’язків. Тому деякі симетричні молекули не полярні (Наприклад, СН4, ССl4 і т.п).
Характеристика ковалентного зв’язку
Тип зв’язку |
Сполука |
l, нм |
Е ккал/моль |
Дипольний момент Д |
С – С |
CH3 – CH3 |
0,154 |
85 |
0,00 |
С = С |
CH2 = CH2 |
0,134 |
130,4 |
- |
С С |
CH CH |
0,121 |
170,6 |
- |
С – С |
|
0,140 |
121,0 |
0,00 |
С – Н |
CH3 – CH3 |
0,109 |
- |
0,30 |
С – О |
CH3 – OH |
0,143 |
70,0 |
1,66(етанол) |
С – S |
C2H5SN |
0,181 |
54,5 |
- |
C – N |
CH3NH2 |
0,147 |
48,6 |
1,30 |
C – P |
R – P |
0,142 |
107,0 |
1,51 |
Полярний зв’язок має безпосереднє відношення до реакційної здатності.
Зв’язок |
Різниця електронегат. |
Дипольний момент (Д) |
|
С – Н |
2,5-2,1=0,4 |
0,30 (СН4) |
|
О – Н |
3,5-2,1=1,4 |
1,66 (СН3ОН) |
|
F – H |
4,0-2,1=1,9 |
2,1 (НF) |
|
Поляризованість зв’язку (динамічна поляризація) – це міна розподілу електронної густини під дією зовнішніх чинників (реагентів, розчинників, каталізаторів). Поляризованість зростає із зменшенням ЕН та із збільшенням радіуса атома і є більш визначальною на реакційну здатність молекули.
Чим більше електрони зсунуті в статичній молекулі, тим менше залишається можливостей для їх зсуву під дією зовнішнього поля.
Найменш полярна молекула HJ являє собою саму сильну кислоту: у водному середовищі завдяки високій поляризованість легко відщеплює протон. Поляризованість молекул має важливе значення для пояснення поведінки речовин в момент реакції.
Поляризованість має розмірність об’єму – см3.
Характеристика полярності і поляризованості зв’язків
Зв’язок |
ЕН Hal і С ел. вольт |
Дипольний момент Д |
Ковалентний радіус нм |
Поляризованість см3/моль |
Н – F |
4,0 |
1,9 |
0,064 |
1,05 CH3F |
H – Cl |
3,0 |
1,04 |
0,099 |
5,93 CH3Cl |
H – Br |
2,8 |
0,79 |
0,114 |
8,80 CH3Br |
Н – J |
2,5 |
0,38 |
0,133 |
13,76 CH3J |
H – C |
2,5 |
0,30 |
0,077 |
1,69 |
Характеристика типових ковалентних зв’язків
Зв’язок |
Сполука |
Довжина зв’язку |
Енергія ккал/моль |
Дипольний момент |
С – С |
CH3 - CH3 |
0,154 |
85 |
0,00 |
С – Н |
CH4 |
0,109 |
98,7 |
0,30 |
С – О |
CH3OH |
0,143 |
70,0 |
1,66 |
С – S |
C2H3-SH |
0,181 |
54,5 |
- |
C – N |
CH3NH2 |
0,147 |
48,6 |
1,30 |
C – F |
R-F |
0,142 |
107,0 |
1,51 |
Природа хімічного зв’язку з точки зору квантової хімії.
В утворенні ковалентного зв’язку суттєву роль відіграє електрон. Для розуміння природи хімічного зв’язку потрібно добре знати природу електрона.
В кінці 20-х років з’явились дані про квантову природу електрона. Квантова механіка постулює, що електрон володіє властивостями частинки і хвилі. Дійсно, неможливо одночасно визначити певні точні координати електрона в атомі (віддаль від ядра і момент кількості руху (т.б. швидкість) – інакше – прослідкувати траєкторію руху електрону.
Рух електрона носить хвильовий характер і може бути описаний за допомогою хвильових функцій (x, y, z). Квантова механіка дозволяє визначити лише ймовірність перебування е з даною Е в даній точці простору, яка пропорційна квадрату хвильової функції 2. Якщо уявити собі е розмазаним в просторі у вигляді е-хмари, то 2 характеризує густину е-хмари. Рівняння Шредінгера (1926р. австр. фізик) зв’язує хвильову функцію (x, y, z) з повною енергією електрона.
Слідкуючи за ймовірністю знаходження даного електрону з даною Е в часі, одержують хмару від’ємного заряду, певним чином розміщену вздовж ядра – атомну орбіталь (АО). АО називають ділянку простору, в якій е з даною енергією проводить більшу частину (95%) часу (ймовірність знаходження електрону близька до 1). АО включає до 95% електронної частини даного е з даною Е.
АО мають різну форму. Проміжні форми відсутні.
Перехід електрона з одного стану в інший (з однієї АО на іншу) здійснюється стрибкоподібно. В цьому полягає дискретність поводження е в атомі.
Кожна АО характеризується своїм набором квантових чисел:
n – головне 1, 2, 3...
l – побічне, орбітальне, азімутальне від 0 до n-1
m – магнітне m=l
S/ms – спінове = +1/2 і –1/2
Форма атомної орбіталі пов’язана з побічним квантовим числом. Для наочності АО зображують у вигляді поверхні, яка обмежує ділянку максимального перебування е (граничну поверхню). Про е, стан якого характеризується будь-яким значенням n і l=0 говорять, що він знаходиться на орбіталі s-типу. Ця орбіталь має сферичну симетрію.
Ділянка простору, ймовірність перебування е в якій дорівнює 0, називається вузловою.
Для 2s е – це сфера всередині, для р-е – це взаємноперпендикулярні площини, що проходять через ядро.
Розподіл електрона в атомі по відповідних атомних орбіталях відбувається за принципом Паулі (в атомі немає е, які мали б однакові 4 квантових числа, т.б. на одній орбіталі не більше двох електронів) і за правилом Гунда (на АО е розміщуються таким чином, щоб спін був максимальним).
У зв’язку з цим, вважають, що рушійною силою утворення зв’язку є електростатичне притягання між е і позитивно зарядженого ядра.
Утворення стійких октетів – це вже наслідок. Дійсно, при утворенні зв’язку кожний електрон притягується вже двома ядрами, тому утворення такої комбінації енергетично вигідно. Але це є взаємодія не крапкових зарядів, а е-ділянок. В процесі утворення зв’язку відбувається перекривання (суперпозиція) відповідних АО.
Молекула водню значно менша радіуса одного атома. Відбувається стискування е-хмари і вона ущільнюється між ядрами.
Перекривання атомних орбіталей здійснюється у відповідності з принципом максимального перекривання (Полінг, 1931р.) в напрямку найбільшої електронної густини. Тобто, напрямок перекривання хмар такий, що орбіталі зв’язуючих електронів перекриваються в найбільшій ступені при даній між’ядерній віддалі. Чим більше перекривання, тим міцніший зв’язок. Принцип максимального перекривання пояснює направленість ковалентного зв’язку. Порушення принципу максимального перекривання приводить до розриву зв’язку. Тому молекули, що містять більше двох атомів, мають колову просторову конфігурацію.
Йонний зв’язок цими властивостями не володіє. Кількість протонів залежить від АО, а від розмірів іонів і типу кристалічної решітки.
Розрізняють: 1)-перекривання, якщо АО перекриваються вздовж осі, що з’єднує ядра двох атомів. Такий зв’язок називається сигма-зв’язком.
Міцність зв’язку залежить від е-густини в місці перекривання.
Полінг вирахував
тип -зв’язку |
S-S |
P-P |
sp2- sp2 |
sp3-sp3 |
відносна міцність |
1,0 |
1,73 |
1,99 |
2,0 |
2) Пі-перекривання приводить до утворення -зв’язку. Пі-зв’язок утворюється шляхом бічного перекривання орбіталей.
-Орбіталі не володіють симетрією. Вони слабше-зв’язків, т.я. для утворення зв’язку ядрам потрібно більше підійти один до одного, при цьому збільшуються сили кулонівського відштовхування між ядрами.
Насиченість. Збуджений стан.
Розподіл е в атомі по типам АО називається електронною конфігурацією.
Електронна конфігурація атома Карбону в основному стані 1s2 2s2 2p2
Кількість неспарених електронів визначає валентність атома. Це пов’язано з поняттям “насиченість зв’язку”. Насиченість означає, що кількість неспарених електронів визначає кількість хімічних зв’язків, які може утворити даний атом (ковалентних). Атом Карбону може перейти в збуджений стан.
Цей процес вимагає затрат енергії (401 кДж/моль). Але витрати енергії компенсуються тим, що такий атом Карбону утворює 4 зв’язки (1053,4 кДж/моль).
Гібридизація
В збудженому стані у атома Карбону s і p-хмари нерівноцінні. Але в метані всі 4 зв’язки рівноцінні. В 1928-1931р. Лайнус Полінг (двічі лауреат Нобелівської премії, амер. вчений) і Слетер незалежно один від другого пояснили це явище гібридизацією. Вони постулювали, що різні орбіталі змішуються і утворюють рівноцінні гібридизовані орбіталі.
В гібридизацію вступають орбіталі, а не електрони. На орбіталях розміщуються електрони, і їх кількість визначається будовою атома.
Гібридизіація властива тільки молекулам, а не атомам.
Довгий час вважали, що гібридизація – це один з підходів, який дозволяє пояснити будову молекул. Зараз доказано, що гібридизація існує. В гібридній орбіталі електронна густина зміщується до зовнішньої долі. На відміну від s і p-орбіталі вона полярна і тому утворює більш міцні зв’язки.
Валентні стани атома Карбону
В сполуках атом Карбону знаходиться в трьох валентних станах
Гібридні орбіталі здатні утворювати міцніші зв’язки, ніж s і p.
Орбіталі |
s-s |
p-p |
sp-sp |
sp2-sp2 |
sp3-sp3 |
Відносна міцність |
1,0 |
1,73 |
1,93 |
1,99 |
2,00 |
Характеристика С-С-зв’язків в алканах, алкенах і алкінах
|
Довжина зв’язку (нм) |
Е кДж/моль |
Валентний кут |
Е |
СH3-CH3 CH2=CH2 CHCH |
0,154 0,133 0,120 |
348 614 810 |
10928 120 180 |
- 266 196 |
В 60-х роках каталітичним окисленням ацетилену була одержана третя модифікація Карбону – карбін (В.В.Коршак, А.М.Сладков та ін.). Це лінійний полімер, в якому чергуються одинарні і потрійні. В 1969р. одержана його різновидність, в якій атоми Карбону зв’язані подвійними зв’язками (полікармулен).
Порівняння одинарного і кратних зв’язків показує, що подвійний зв’язок більш міцний, ніж одинарний, але Е с=с не вдвічі більше Е с-с. Подвійний зв’язок являє собою комбінацію і -зв’язків і -зв’язок слабше від сигма. -Зв’язок зображують у вигляді хмари від’ємного заряду, розміщеного над і під площиною -зв’язку і називаються -молекулярною орбіталлю.
Молекулярними орбіталями в квантовій хімії називаються орбіталі, які утворені внаслідок комбінації атомних орбіталей і охоплюють ядра всіх зв’язаних атомів.
Існує також інший опис подвійного зв’язку, запропонований Полінгом. Він виходив з відсутності елементарних доказів того, що два зв’язки різні.
Він припустив, що і -зв’язки перетворюються і утворюють дві рівноцінні -зв’язки (бананові).
Потрійний зв’язок характеризується як комбінація 1 сигма і 2 -зв’язків. Перекривання двох взаємноперпендикулярних р-орбіталей утворює -МО, яка має циліндричну симетрію.
Валентним станам Карбону відповідають алотропні видозміни: алмаз, графіт і карбін.
Тип гібридизації визначає симетрію молекули, валентні кути. Кути не завжди точно відповідають гібридизації, т.я. тут ще проявляються сили взаємного відштовхування. У NH3 і H2O атоми N і О в стані sp3-гібридизації, а валентні кути відповідно 107 і 104,5, у етану – 112,2, в етилені – 116,8.
Гібридизацією пояснюється багато властивостей. Змінюється форма гібридної орбіталі, доля s-орбіталі збільшується в ряду sр3sр2sр, змінюється довжина зв’язку, ковалентний радіус.
Із зміною стану гібридизації Карбону, змінюється його електронегативність (ЕН). Так як границя електронної хмари наближається до ядра (у sp – найбільша електронегативність).
Таблиця
Характеристика Карбону в різних валентних станах
Валентний стан |
Тип гібридизації |
Частка s-орбіталі |
Ковалентний радіус “Снм” |
ЕН електрон/вольт |
Алотропна видозміна |
І ІІ ІІІ |
sp3 sp2 sp |
¼ 25% 1/3 35% ½ 50% |
0,0767 0,0742 0,0668 |
2,50 2,67 2,75 |
алмаз графіт карбін |
Зміни в характеристиці атома Карбону викликають відповідні зміни характеристик ковалентних зв’язків.
Таблиця
Характеристика зв’язків С—Н
Вуглеводень |
Тип гібридизації |
Частка s- орбіталі |
Довжина С—Н зв’язку |
ЕН атома Карбону |
Дипольний момент С—Н (D) |
Кислотні властивості С—Н |
С2Н6 С2Н4 С2Н2 |
sp3 sp2 sp |
25% 33% 50% |
0,11 0,108 0,106 |
2,5 2,62 2,75 |
0,307 0,629 1,05 |
— ~ 10-40 ~ 10-22 |
Збільшення електронегативності “С” в стані sp-гібридизації приводить до збільшення полярності зв’язку С—Н в ацетилені і можливість відщеплення Н під дією сильних основ з утворенням ацетиленідів. Ізоелектронність — відповідність в електронній будові. Ізоелектронними називають структури (атоми, іони, молекули), які мають однакову будову електронних оболонок, але різний заряд ядра.
ІІ період
n |
1 2 |
Be B C N O F |
2 2 2 3 2 4 2 5 2 6 2 7 |
Ковалентність – число ковалентних зв’язків, координаційне число – число атомів, з яким зв’язаний даний елемент.
Ізоелектронні структури подібні до просторової конфігурації.
Правила для визначення типу гібридизації:
Sp3-гібридизація – сумарна кількість -зв’язків і неподільних е пар рівне 4. Якщо любий атом пов’язаний з Карбоном в стані sp2 або sp-гібридизації, то він також буде в sp2-гібридизації.
sp2 – сумарне число замісників і НЕП рівне 3. sp – сумарне число замісників і НЕП рівне 2. Наприклад:
Розподіл електронної густини в молекулі. Електронні ефекти.
Хімічні реакції являють собою процеси, в яких проходить перерозподіл електронної густини. Напрямок (тим більше основні продукти) і механізм реакції суттєво залежить від розподілу е у вступаючих у взаємодію молекул. Як правило, е розподіляються нерівномірно. Розподіл е визначається як природою атомів в молекулі, так і взаємним впливом атомів у молекулі. Взаємний вплив викликає поляризацію молекул і впливає на реакційну здатність.
Наприклад:
СН3СООН Ка 10-5 1,75 СlCH2COOH 139 |
Індуктивний вплив, індукційні ефекти.
Термін був запропонований Л’юїсом. Заключається в передачі впливу шляхом послідовної поляризації -зв’язків. Викликається асиметрією зв’язку і може поширюватись вздовж ланцюга зв’язаних атомів по механізму електростатичної індукції. ClCCC- Первинний диполь CCl завдяки створюваного ним поля індукує в сусідньому зв’язку вторинний дипольний момент ( ). Цей диполь діє аналогічно на сусідній зв’язок, але слабше. Тобто ++. У випадку з хлороцтовою кислотою це приводить до збільшення полярності зв’язку ОН і кислотних властивостей. Асиметрія зв’язку ClC передається по ланцюгу простих зв’язків.
Характерною особливістю індуктивного механізму передачі впливу атомів в молекулі є те, що всі заміщені електронні пари залишаються зв’язаними зі своїми початковими атомними октетами. Зміни торкаються тільки їх положення відносно своїх атомів.
Характерні риси індукційного ефекту.
1. Індукційний ефект впливає на всі атоми насиченого ланцюга в одному напрямку. При цьому І-ефект може бути “+” або “–” направленим. Знак визначають по частковому заряду, який набуває замісник, який викликає даний ефект. Напрям зсуву заряду позначається прямими стрілками. Електроноакцепторні замісники викликають –І, а електронодонорні +І.
І ефект Н=О (умовно) СН має дипольний момент, 0,3D.
2. Сила індукційного ефекту залежить від природи замісника, від його електронодонорних або електроноакцепторних властивостей, і від їх кількості.
3. “+” заряджені групи викликають більший –І-ефект, ніж групи з частковим +.
Вплив характеру замісника на кислотні властивості карбонових кислот.
Сполука |
Ка10-4 |
Сполука |
Ка10-5 |
HCH2COOH JCH2COOH BrCH2COOH ClCH2COOH FCH2COOH |
0,176 6,68 12,53 13,59 25,96 |
FCH2COOH F2CHCOOH F3CCOOH
|
259,6 5700,0 50000,0 |
Сполука |
рКа (Н2О, 250) |
Сполука |
рКа |
|
ClCH2COOH |
2,86 |
CH2=CHCOOH |
4,25 |
|
+NH3CH2COOH |
2,31 |
C6H5COOH |
4,20 |
|
NO2CH2COOH |
1,68 |
CH3CCCOOH |
2,65 |
|
|
|
CH3COOH |
4,76 |
|
|
|
|
|
|
Ненасичені групи проявляють слабкий —І-ефект, який збільшується в ряду:
СН2=СН— < СН2=СН—CH—CH— < CHC—
Це пов’язане зі збільшенням ЕН атома Карбону в sp3 < sp2 < sp гібридному стані.
1. Алкільні радикали проявляють слабкі електронодонорні властивості, що викликають +І-ефект. Чим більший радикал, тим більший ефект.
Вплив алкільних радикалів на кислотні властивості карбонових кислот
-
Сполука
Ка*10-5
HCOOH
CH3COOH
C3H7COOH
(CH3)2CHCOOH
(CH3)3COOH
17.72
1.76
1.50
1.36
0.93
Всі замісники можна розмістити в ряд індуктивного впливу:
NO2, +NR3, F > —OR > —NR2 > —CCR > C6H5 > CH=CR2 }
{CH3O- > Na > C(CH3)3 > CH(CH3)2 > — CH2CH3— > CH3
2. Індуктивний ефект швидко затухає по ланцюгу. З віддаленням на 2 ‑ 3 вуглець — вуглецеві зв’язки І-ефект майже рівний 0.
3. Вплив положення замісника на кислотні властивості карбонових кислот.
-
Сполука
Ка*10-5
CH3CH2®COOH
1.54
CH3CH2—CHCOOH
¯
Cl
135.9
CH3CH—CH2COOH
¯
Cl
8.9
CH2¬CH2¬CH2COOH
¯
Cl
3.0
Мезомерний ефект (ефект спряження, резонансний ефект)
Це ще один механізм передачі взаємного впливу атомів, не зв’язаних один з одним. Під дією мезомерного ефекту відбувається перерозподіл густини в молекулі. Але, на відміну від І-ефекту цей перерозподіл супроводжується не через систему -зв’язків, а через систему, в основному, - і р (неподільних пар електронів).
Він спостерігається в спряжених системах, які містять -зв’язки неподільні електронні пари або -С—Н зв’язки, віддалені від -елктронів, або один від одного простим -зв’язком. В залежності від типу спряжених молекул розрізняють декілька типів мезомерного ефекту.
-
Тип спряження молекули
Вид мезомерного ефекту
1. СН2=СН—СН=СН2
1,3-бутадієн
є чергування одинарних і подвійних зв’язків, через один -зв’язок
СН2=СН—СН—СН=СН2
(спряження немає)
--спряження
2. СН2=СН—Сl
вінілхлорид
-зв’язок і р-електрони на віддалі одного сігма-зв’язку
р--спряження
3.
пропілен
один атом водню віддалений від
-зв’язку -зв’язком
--спряження
(надспряження, гіперконьюгація)
На відміну від І-ефекту, де електрони лише частково зміщені відносно вихідних положень в своїх октетах, при М-ефекті відбувається послідовне переміщення електронних пар сусідніх октетів далі по ланцюгу -зв’язків до останнього атома, на якому локалізується електронна пара (або частковий заряд).
Мезомерний ефект — це перерозподіл електронної густини шляхом перекривання -електронних ділянок з сусідніми - або - С—Н ділянками, внаслідок якого утворюється спільна -хмара.*
Перекривання означає, що електронні дублети частково або повністю переміщаються в сусідні октети, викликаючи далі аналогічні переміщення електронних пар сусіднього октету на наступний, або на крайній атом, де електронна пара локалізується у вигляді неподільної пари.
В сі
три атоми мають р-орбіталі осі яких
паралельні. Ніщо не заважає р-орбіталям
атома хлору своєю неподіленою парою
електронів перекритись з пі-звязком,
внаслідок чого утворюється спільна
пі-електронна хмара. Перекривання
означає, що надлишок електронної густини
у вигляді цієї пари електронів
переміщується частково в октет сусіднього
атома Карбону і заставляє пі-електронну
пару зміщуватись далі, до крайнього
атома Карбону, де надлишок електронів
локалізується у вигляді часткового
негативного заряду. На атомі хлору при
цьому виникає частково позитивний
заряд.
сі
три атоми мають р-орбіталі осі яких
паралельні. Ніщо не заважає р-орбіталям
атома хлору своєю неподіленою парою
електронів перекритись з пі-звязком,
внаслідок чого утворюється спільна
пі-електронна хмара. Перекривання
означає, що надлишок електронної густини
у вигляді цієї пари електронів
переміщується частково в октет сусіднього
атома Карбону і заставляє пі-електронну
пару зміщуватись далі, до крайнього
атома Карбону, де надлишок електронів
локалізується у вигляді часткового
негативного заряду. На атомі хлору при
цьому виникає частково позитивний
заряд.
Ефективно перекриваються лише р-орбіталі з паралельними атомами. Тому мезомерний ефект спостерігається в планарних системах, в яких кожен сусідній атом має рz орбіталі перпендикулярні площині сігма-звязків.
Перерозподіл електронної густини призводить до зміни кратності зв’язку: одинарний зв’язок стає частково подвійним, а подвійний — частково одинарним. Йде вирівнювання зв’язків:
СН2=СН—Сl -CH2—CH=Cl+ -CH2 = CH = Cl+ (запис з допомогою резонансних структур)
Звідси назва — мезомерний ефект.
Граничні структури не існують реально. Існує мезоформа.
Мезомерний ефект може бути неполярний (М), позитивним (+ М) чи негативним (- М). Визначається знаком, який виникає на заміснику, який викликає цей ефект.
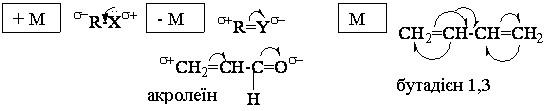
Мезомерний ефект впливає на будову, властивості і реакційну здатність сполук.
Полярність: +М-ефект у вінілхлориді зменшує полярність і знижує реакційну здатність молекули по зв’язку С—Сl (сполука не піддається гідролізу, на відміну від СН3-СН2Cl).
CH3-CH2F CH2=CH-F
• I (— I)
W = — 1,92 W = — 1,42
(— М)-ефект в акролеїні збільшує полярність
На відміну від І-ефекту, М-ефект передається по системі -зв’язків не послаблюючись.
--спряження значно слабше , і ,Р спряження, оскільки тут перекриваються -е хмари з хмарами сусідніх —СН зв’язків. Тому перекривання часткове і не таке ефективне.
|
|
|
|
Електронна густина зміщується в бік подвійного зв’язку.
На відміну від І-ефекту сила М-ефекту алкільних радикалів зменшується від СН3 до більших.
СН3 > СН3CH2 > СН3—CH > (СН3)3C
М(відсутній)
М — зменшується
І — збільшується
Мезомерний ефект стабілізує молекулу (понижує її енергію).
КЛАСИФІКАЦІЯ ОРГАНІЧНИХ РЕАКЦІЙ
І. По направленості і кінцевому продукту:
1. Реакції приєднання (А)
алкен 1,2-дибромалкан
2. Реакції відщеплення (елімінування) (Е)
3. Реакції заміщення (S)
A—B + C AC + B
R—H + Cl2 RCl + HCl
R—Cl + :OH- ROH + :Cl-
субстрат реагент
4.
ІІ По характеру реагуючих частинок і типу розриву ковалентного зв’язку.
1. Гомолітичні (радикальні)
Реагентами в них є радикали
Умови протікання: газова фаза, висока температура, дія променевої енергії, хімічна енергія.
2. Гетеролітичні реакції (іонні, полярні). Проходять в полярних розчинниках або під впливом каталізатора.
В залежності від характеру реагенту поділяються:
а) нуклеофільні (йдуть за рахунок нуклеофіла) А:B + I- A:I + :B-
СН3—СН2:Br + :OH- СН3СН2:OH + :Br- (SN)
Б) електрофільні – якщо утворення нового зв’язку відбувається за рахунок е-субстрата; реагент – електрофіл
А:В + Z+ A: Z + B+
Реагенти класифікують в залежності від того, мають вони чи не мають спорідненість до електрону чи до ядра, чи однакове до електрону і ядра (радикали).перші два типи йдуть з парною кількістю електронів, другі – з непарною.
Нуклеофільні реагенти – це аніони або молекули з вільними електронними парами, або містять легко поляризовані е-хмари (алкени, арени), які в реакціях дають свої електрони для утворення нового зв’язку в молекулах і атакують в молекулі субстрата ділянку з дефіцитом електронів
Електрофіли – це катіони або молекули з незаповненими е-оболонками , дія яких пов’язана з прийманням е-пари в ході реакції. Вони атакують ділянку субстрату з надлишком е-густини.
Нуклеофіли – донори, є основи Л’юїса. Електрофіли – акцептори, є кислоти.
Електрофільні і нуклеофільні реакції можна розглядати як узагальнення кислотно-основних реакцій. В основі цього лежить теорія кислот і основ.
Треба розрізняти нуклеофільність і основність. Основність відбиває спорідненість до протону. Нуклеофільність – спорідненість до атома Карбону.
Основність характеризується константою рівноваги, нуклеофільність – за допомогою швидкості реакції.
Наприклад, НО– Br– аніон сильної кислоти, є слабкою основою, а нуклеофільність ОН– Br–.
ІІІ. Молекулярність реакції.
Розрізняють по числу молекул, в яких відбуваються реальні зміни ковалентних зв’язків (в період лімітуючої стадії):
1) мономолекулярні (одна молекула);
2) бімолекулярні (дві молекули).
Присутність серед нуклеофілів катіонів Sn2+, а серед електрофілів аніонів S2О82- свідчить про те, що характер реагенту визначається його будовою, а не зарядом частинки.
