
- •Львівський державний медичний університет ім. Данила Галицького обмін вуглеводів: біохімічні та клінічні аспекти
- •Література
- •1. Загальні шляхи обміну вуглеводів
- •2.Травлення вуглеводів.
- •3. Роль печінки в обміні вуглеводів
- •4. Роль гормонів в регуляції глюкози
- •4.1. Біосинтез інсуліну
- •4.2. Секреція інсуліну та транспорт його кров’ю.
- •4.3. Механізм дії інсуліну
- •4.4. Глюкагон та його дія.
- •5. Механізми регуляції обміну вуглеводів, білків та ліпідів.
- •Аденілатциклазна месенджерна система.
- •6. Порушення регуляторних механізмів вуглеводного обміну
- •7. Причини, що призводять до виникнення діабету.
- •8. Порушення вуглеводного, білкового, жирового обмінів при дефіциті інсуліну.
- •9. Біохімічні порушення при нестачі інсуліну.
- •Методи біохімічної діагностики цукрового діабету.
- •Критерiї дiагностики цукрового дiабету.
- •11. Експериментальний цукровий діабет
- •12. Класифікація цукрового діабету
- •4.Порушення толерантності до глюкози:
- •2.Діабет, поєднаний із гормональними порушеннями:
- •12.1 Діабет, поєднаний із захворюваннями підшлункової залози.
- •12.2. Діабет, поєднаний із гормональними порушеннями.
- •12.3. Діабет, пов’язаний із генетичними синдромами.
- •12.4. Діабет, зумовлений токсичними речовинами та фармакологічними агентами.
- •12.5. Порушення толерантності до глюкози.
- •13. Спадкові порушення вуглеводного обміну
- •Література
- •Дедов и.И., Сунцов ю.И., Курякова с.В., Рыжкова с.Г. Эпидемиология инсулинзависимого сахарного диабета.// Проблемы эндокринологии, 1998, №2 с.47-51
- •Микаелян н.П, Князев ю.А. Инсулинсвязывающая активность мононуклеарных клеток беременных с сахарным диабетом // Клин. Лад. Диагностика. - 1999. - №9. - с. 23.
4.3. Механізм дії інсуліну
Найбільш чутливі до інсуліну тканини - м’язова, сполучна і в меншій мірі печінка. Нечутлива до інсуліну нервова тканина. В багатьох тканинах виявлені мембранні рецептори до інсуліну, найбільше їх на клітинах, що чутливі до інсуліну. Всі біологічні ефекти інсуліну можна об’єднати в 4 групи:
1) дуже швидкі (секунди): гіперполяризація мембран деяких клітин, зміни мембранного транспорту глюкози, амінокислот та іонів;
2) швидкі (хвилини): активація або гальмування багатьох ферментів (шляхом їх хімічної модифікації);
3) повільні (від хвилини до години): індукція або репресія синтезу ферментів;
4) дуже повільні (від години до декількох діб): реплікація ДНК, проліферація клітин.
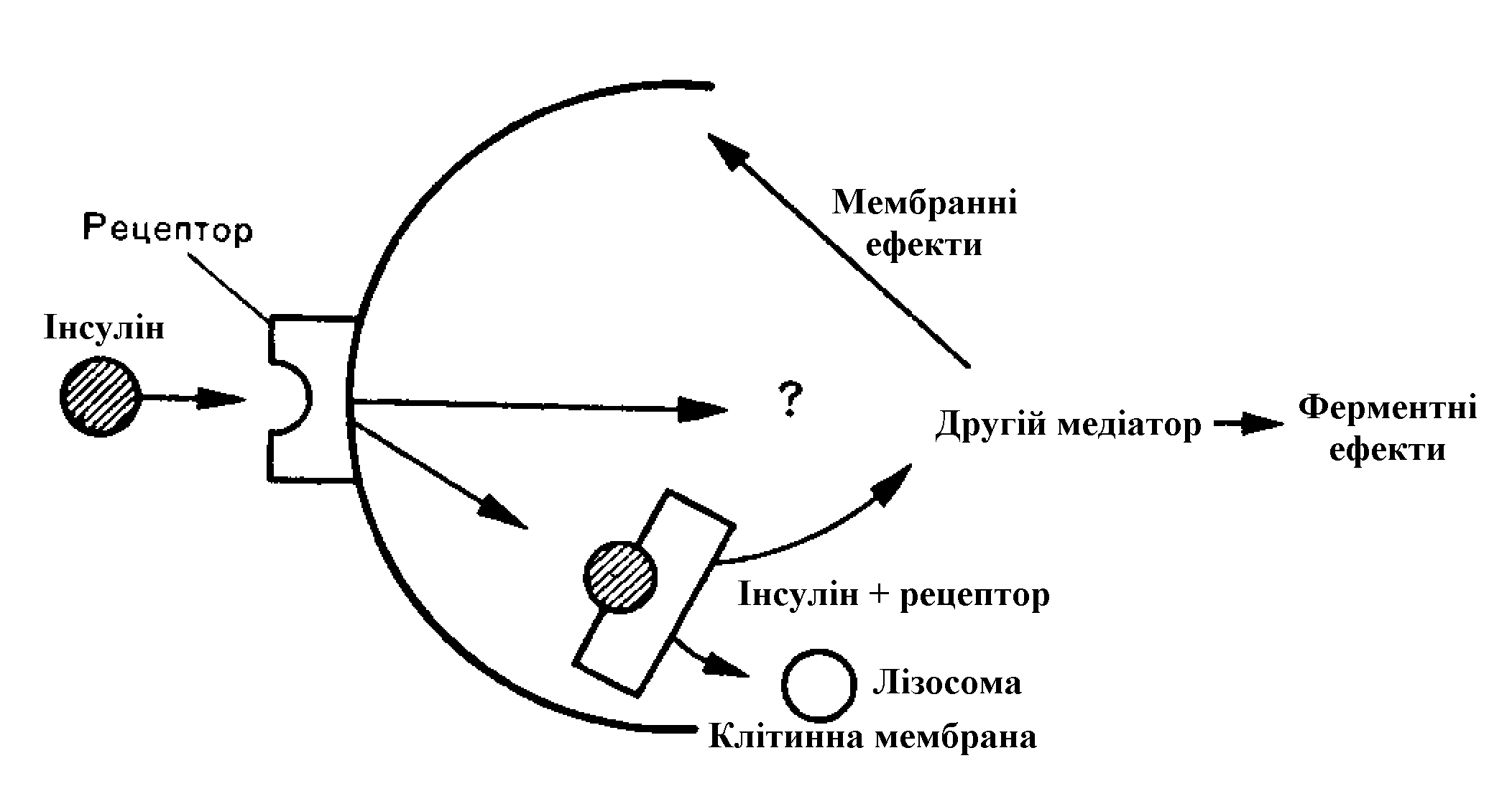
Рис.5. Взаємодія інсуліну з мембранним рецептором клітини.
Інсулін діє, зв’язуючись з специфічними рецепторами цитоплазматичних мембран інсулінозалежних тканин (рис.5). Кількість мембранних рецепторів досягає 250000 в гепатоцитах, але у зв’язуванні інсуліну приймає участь 10-13% від їх загальної кількості у клітині. Вплив інсуліну реалізується за мембранним типом - утворюється інсулінрецепторний комплекс, який підвищує проникливість клітинних мембран для глюкози, амінокислот, іонів кальцію, калію, натрію. Рецептори є компонентами мембран і за своєю структурою є глікопротеїнами.
Інсуліновий рецептор складається з двох субодиниць - і що зв’язані дисульфідними зв’язками.
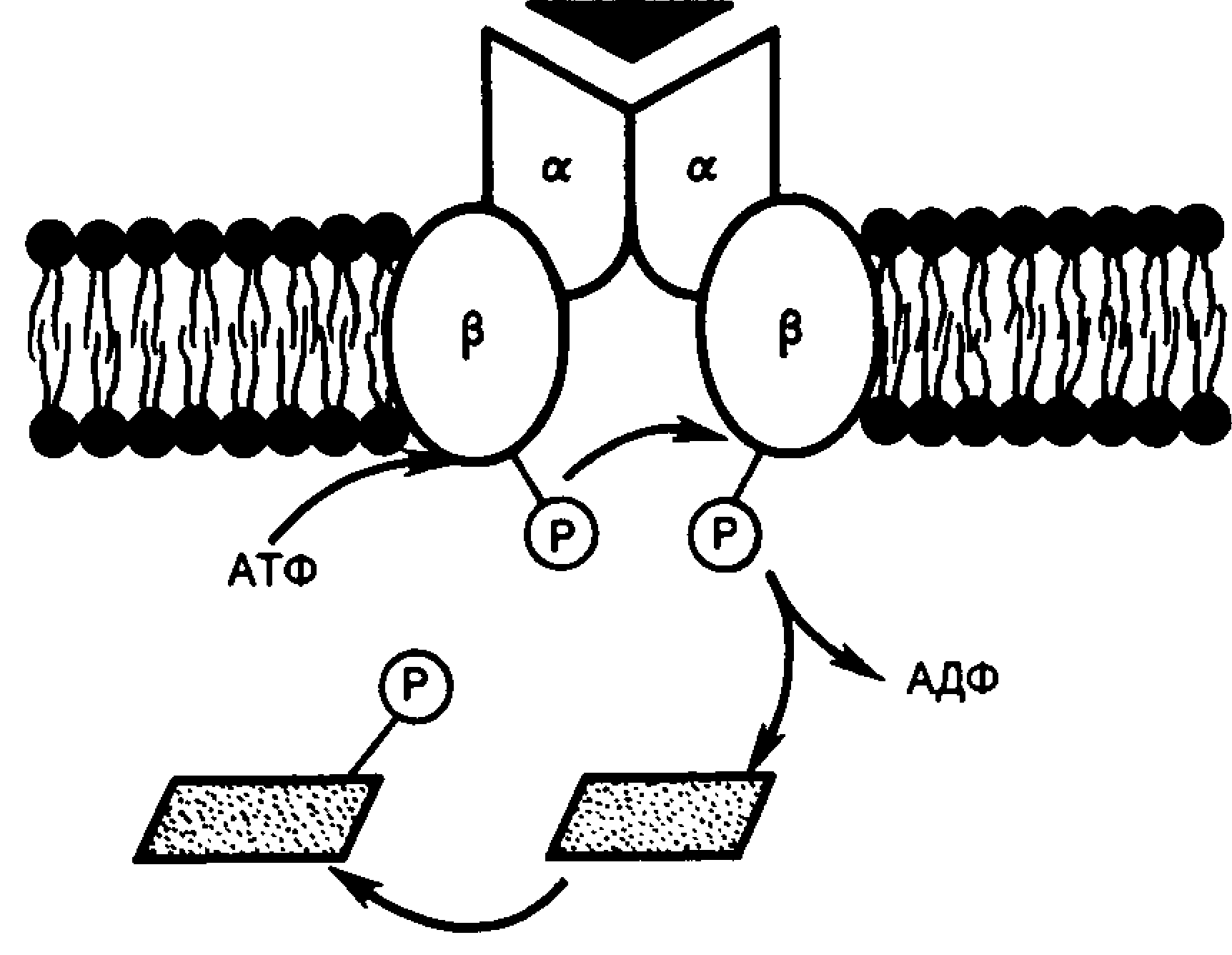
Рис.6. Модель інсулінового рецептора (схема)
a - ланцюги розташовані на зовнішній поверхні мембрани клітини,
b - ланцюги локалізуються трансмембранно.
Виявилося, якщо a- субодиниці (М.м.135 000) майже цілком розміщені на зовнішньому боці біомембрани (рис.6.) і виконують функцію зв’язування інсуліну, b-субодиниці (М.м.95 000) є трансмембранними білками і виконують функцію перетворення сигналу .
Особливістю рецептора інсуліну є те, що він здатний до аутофосфорилювання, тобто рецептор має протеїнкіназну (тирозинкіназну) активність. При зв’язуванні інсуліну з a-ланцюгами рецептора проходить активування b-ланцюгів шляхом фосфорилювання їх тирозинових залишків. У свою чергу активна тирозинкіназа b- ланцюгів запускає каскад реакцій фосфорилювання - дефосфорилювання протеїнкіназ. Це призводить до зміни клітинної активності, що проявляється у активації або інгібуванні ферментів, транспорті глюкози, синтезі нуклеїнових кислот і білків та ін. В цьому механізмі можлива участь внутрішньоклітинного посередника, що контролює транскрипцію генів і відповідно синтез мРНК.
Порушення структури або спорідненності рецептора до інсуліну, активація протеїнкінази або порушення з’єднання між субодиницями є основною причиною цукрового діабету ІІ типу.
Інсулін також полегшує проникнення іонів кальцію в клітини. Це збільшує активність гуанілатциклази і призводить до синтезу цГМФ. З участю останнього та іонів кальцію інсулін впливає на реплікацію, прискорюючи синтез ДНК і РНК, що призводить до посилення синтезу білків. Одночасно іони кальцію активують фосфодиестеразу, що розщеплює цАМФ. Зниження концентрації кальцію веде до гальмування глікогенолізу, глюконеогенезу, а також ліполізу.
Низьке співвідношення цАМФ/цГМФ полегшує синтез глікогену і триацилгліцеринів, а також білків, так як їх синтез на стадії індукції є цГМФ-залежним процесом .
Механізм дії інсуліну пов’язаний з активацією ферментів, що беруть участь у фосфорилюванні глюкози та інших сполук. Активність цих ферментів визначається присутністю інсуліну. Нестача інсуліну призводить до зниження гліколізу та цим самим зменшення утворення макроергічних сполук, необхідних організму для життєдіяльності і пластичних процесів. Інсулін активує глікогенсинтетазу і таким чином посилює синтез і нагромадження глікогену в печінці, а також пригнічує фосфорилази, що веде до гальмування розпаду глікогену.
Інсулін як алостеричний ефектор, взаємодіє з сульфгідрильними групами алостеричного центра ферменту, утворюючи гормон-ферментний комплекс. В останньому відбувається зміна макроструктури гексокінази (Г.К.) і підвищується її стійкість по відношенню до дії глюкокортикоїдів. Важливо відмітити те, що інсулін може не тільки попереджувати інгібуючу дію глюкокортикоїдів, але й усунути її. Механізм цього процесу подібний до взаємодії інсуліну з тіоловими (сульфгідрильними) групами білків клітинних мембран. Гексокіназа своєю тіоловою групою взаємодіє з дисульфідною групою інсуліну, утворюючи гормон-ферментний комплекс, стійкий до дії глюкокортикоїдів
Г



 К
SH
+ S S інсулін
ГК S
S інсулін
SH
К
SH
+ S S інсулін
ГК S
S інсулін
SH
Інсулін сприяє збільшенню концентрації глюкози в клітинах, а остання, в свою чергу, служить індуктором, стимулюючи біосинтез глюкокінази. Активуючий вплив інсуліну на утворення нових молекул глюкокінази може бути прямим, при якому безпосередньо індукується синтез глюкокінази, і непрямим - через накопичення глюкози. Слід відмітити, що високий рівень глюкози в клітині стимулює також синтез ферменту глюкозо-6-фосфатдегідрогенази - ключового каталізатора пентозофосфатного шляху. В цей же час інсулін гальмує активність фермента глюкозо-б-монофосфатази і цим самим запобігає розщепленню гексозофосфатів. Таким чином, цей гормон різними шляхами сприяє підвищенню вмісту глюкозофосфорних ефірів і утилізації вуглеводів у клітині.
Збільшення концентрації глюкозо-6-монофосфату створює умови для активації гліколізу, пентозофосфатного обміну, а також біосинтезу складних вуглеводів (олігосахаридів, глікогену, мукополісахаридів). Інтенсифікація біосинтезу глікогену в значній мірі зумовлена тим, що інсулін активує фермент глікогенсинтетазу в печінці. Описані ефекти дії інсуліну відносяться до швидких.
Інсулін впливає на піруват- і a-кетоглутаратдегідрогеназні процеси. Він активує фермент цитратсинтазу, а в зв’язку з цим відбувається перенесення ацетил -КоА на оксалоацетат у процесі синтезу лимонної кислоти.
