
- •Львівський державний медичний університет ім. Данила Галицького обмін вуглеводів: біохімічні та клінічні аспекти
- •Література
- •1. Загальні шляхи обміну вуглеводів
- •2.Травлення вуглеводів.
- •3. Роль печінки в обміні вуглеводів
- •4. Роль гормонів в регуляції глюкози
- •4.1. Біосинтез інсуліну
- •4.2. Секреція інсуліну та транспорт його кров’ю.
- •4.3. Механізм дії інсуліну
- •4.4. Глюкагон та його дія.
- •5. Механізми регуляції обміну вуглеводів, білків та ліпідів.
- •Аденілатциклазна месенджерна система.
- •6. Порушення регуляторних механізмів вуглеводного обміну
- •7. Причини, що призводять до виникнення діабету.
- •8. Порушення вуглеводного, білкового, жирового обмінів при дефіциті інсуліну.
- •9. Біохімічні порушення при нестачі інсуліну.
- •Методи біохімічної діагностики цукрового діабету.
- •Критерiї дiагностики цукрового дiабету.
- •11. Експериментальний цукровий діабет
- •12. Класифікація цукрового діабету
- •4.Порушення толерантності до глюкози:
- •2.Діабет, поєднаний із гормональними порушеннями:
- •12.1 Діабет, поєднаний із захворюваннями підшлункової залози.
- •12.2. Діабет, поєднаний із гормональними порушеннями.
- •12.3. Діабет, пов’язаний із генетичними синдромами.
- •12.4. Діабет, зумовлений токсичними речовинами та фармакологічними агентами.
- •12.5. Порушення толерантності до глюкози.
- •13. Спадкові порушення вуглеводного обміну
- •Література
- •Дедов и.И., Сунцов ю.И., Курякова с.В., Рыжкова с.Г. Эпидемиология инсулинзависимого сахарного диабета.// Проблемы эндокринологии, 1998, №2 с.47-51
- •Микаелян н.П, Князев ю.А. Инсулинсвязывающая активность мононуклеарных клеток беременных с сахарным диабетом // Клин. Лад. Диагностика. - 1999. - №9. - с. 23.
4. Роль гормонів в регуляції глюкози
4.1. Біосинтез інсуліну
Важлива роль у регуляції обміну вуглеводів належить інсуліну.
У 1921 році Бантінг та Бест виділили з підшлункової залози екстракт з високою біологічною активністю, що зменшує або запобігає розвитку гіперглікемії та глюкозурії. У 1925 р. Абель отримав кристалічний інсулін, а у 1953 р. Сенджером та співавторами була розшифрована його структура.
Інсулін синтезується b-клітинами підшлункової залози (рис.4.) з амінокислот, що поступають з крові або утворюються в цих клітинах. Спочатку проходить синтез препроінсуліну (М.м 14500), який перетворюється у просторі трубочок ендоплазматичного ретикулуму в проінсулін. Його синтез починається з b-ланцюга та закінчується a-ланцюгом. Між ними локалізується С-пептид, який складається з 33 амінокислот. Всього проінсулін містить 78-86 амінокислотних залишків у залежності від виду тварини.
Синтез проінсуліну проходить в рибосомах ендоплазматичного ретикулуму. Цей процес активується глюкозою, яка сприяє утворенню і-РНК проінсуліну та посилює процеси трансляції. Після біосинтезу проінсулін транспортується у цистерни апарату Гольджі, де проходить його конверсія в інсулін, при цьому від проінсуліну відщеплюється С-пептид під дією ферментів, що подібні до трипсину та карбоксипептидази В. С-пептид відщеплюється в гранулах b-клітин перед секрецією у кров, і виділяється у кількостях еквівалентних кількості інсуліну. Відомо декілька проміжних форм проінсуліну (інтермедіат - І, інтермедіат-ІІ). Біологічна активність проінсуліну становить 2-20% активності інсуліну. Специфічних проінсулінових рецепторів у тканинах не виявлено. Він сприяє метаболізму глюкози у жировій тканині та м’язах.
Молекула інсуліну побудована з двох поліпептидних ланцюгів: А-ланцюг вміщає 21, а В-ланцюг - 30 амінокислотних залишків. Обидва ланцюги пов'язані між собою двома дисульфідними мостиками між залишками цистеїну у положенні А7 та В7, А20 - В19. А -ланцюг має внутрішній дисульфідний зв’язок А6 - А4. У 1965 р. вперше проведений лабораторний синтез інсуліну. Виявлені видові особливості його будови. Найбільш близькими за своїм амінокислотним складом є молекули інсуліну людини, свині, собаки, кита, кроля, які відрізняються однією амінокислотою у положенні В30. Молекула інсуліну у просторі знаходиться у скрученому стані (вторинна та третинна структури молекули). Відщеплення однієї амінокислоти або заміна її з будь - якого кінця А-ланцюга веде до втрати активності інсуліну. У більшості організмів його полімеризація в підшлунковій залозі проходить навколо атома цинку, при цьому навколо кожного з 2-х атомів металу утворюється по 3 молекули. Ці цинк-інсулінові гексамери знаходяться у вигляді кристалів, що депонуються у b-клітинах. Гексамери вивільняються з b-клітин при відповідних значеннях рН середовища, дисоціюють на димери та мономери. Біосинтез інсуліну активується глюкозою.
4.2. Секреція інсуліну та транспорт його кров’ю.
У b-клітинах транспортна система представлена системою мікротубул, які є актиноподібні і здатні скорочуватись та розслаблюватись і таким чином пересувати гранули. Біля плазматичної мембрани клітин локалізовані мікрофіламенти, які охоплюють гранулу, яка містить івнсулін, підводять її до мембрани і після їх злиття відбувається екструзія гранул-вихід назовні, інсулін при цьому стає розчинним. (рис.4).
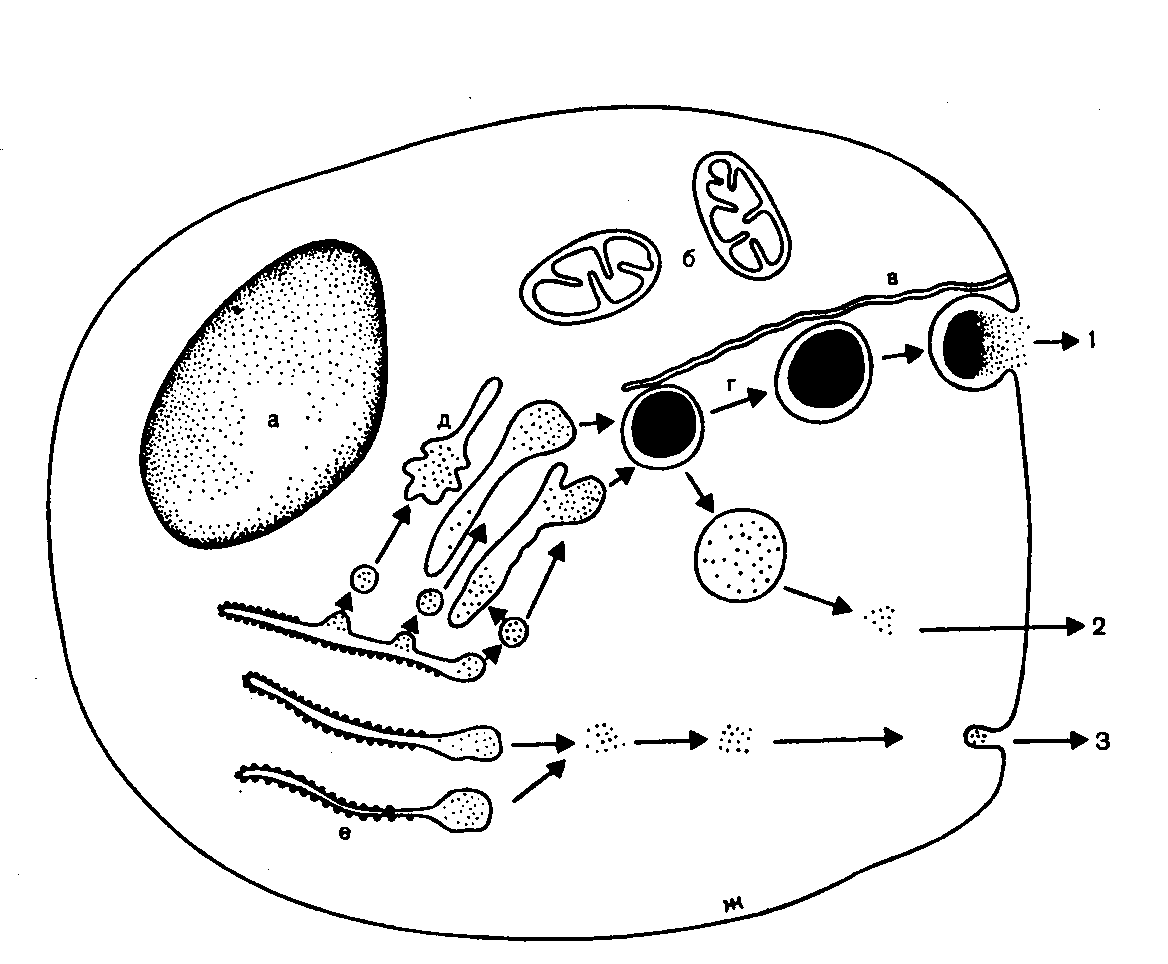
Рис. 4. Біосинтез та секреція інсуліну b-клітиною.
а-ядро клітини; б-мітохондрії;в-мікроканальцева система; г-гранули; д-пластинчастий комплекс; е-крипти ендоплазматичного ретикулуму; ж-мембрана клітини.
Препроінсулін, що синтезується у ендоплазматичному ретикулумі (е) перетворюється в проінсулін, який транспортується у цистерни апарату Гольджі (д) де проходить відщеплення від проінсуліну С-пептиду і утворюється інсулін. Інсулін виділяється трьома шляхами -1, 2 , 3. 1.- із гранули в перикапілярний простір; 2,3-самостійний вихід інсуліну в позаклітинний простір.
Вивільнення інсуліну острівцями підшлункової залози становить 3,8-4,4 ммоль/л, максимальне біля 16,6 ммоль/л. Концентрація глюкози та рівень виділення інсуліну має чітку залежність.
У цільній крові людини концентрація глюкози становить 3,33-5,55 ммоль/л, у плазмі - 3,33-6,11 ммоль/л. D- глюкоза крові складається з двох форм a-глюкози (34%) та b-глюкози (66%). a-ізомер має більш стимулюючу дію на виділення інсуліну.
Вважається, що генератором секреторного процесу у b-клітині є глюкоза та її метаболіти. Секрецію інсуліну, крім глюкози, стимулюють гормони шлунково-кишкового тракту (гастрин, секретин, холицистокінін, вазоактивний інтенстинальний поліпептид). Адреналін і норадреналін гальмують секрецію інсуліну.
Важливе значення мають іони Са2+ у запуску секреції інсуліну шляхом активації мікротубулярно- мікрофіламентної системи. Деполяризація мембрани b-клітин , яку викликає глюкоза, іони Са2+, К+ , поєднується з підвищенням секреції інсуліну. Екстрацелюлярний Са2+ входить у b-клітини під впливом глюкози, одночасно у цитоплазмі вивільняється внутрішньоклітинний Са2+, тобто збільшується іонізована частина Са2+, який разом з кальмодуліном збільшує секрецію інсуліну шляхом активації мікротубулярно-мікрофіламентної системи, яка забезпечує екзоцитоз секреторних гранул.
Антагоністом Са2+ у функціональній активації b-клітин є іони магнію, які гальмують включення Са2+ у b-клітини та виділення інсуліну. Суттєву роль відіграють також іони Na+ та К+, які сприяють метаболізму глюкози у b-клітинах, активують деякі ферменти (піруваткіназу, АТФ-азу), прискорюють гідроліз АТФ. Секреція інсуліну пов’язана з концентрацією ц-АМФ у b-клітинах. Ц-АМФ активує протеїнкінази та фосфопротеїнкінази, які в свою чергу активують специфічні білки та ензими мікротубулярної системи b-клітин, що впливає на секрецію інсуліну. Інсулін у плазмі крові знаходиться у вільному та зв’язаному з білками станах. Існують дві форми зв’язаного інсуліну: 1) комплекс інсуліну з трансферином; 2) комплекс інсуліну з глобулінами сироватки крові. Зв’язаний інсулін відрізняється від вільного за біологічними, імунними та фізико-хімічними властивостями, а також швидкістю до метаболізму, поведінкою у електрофоретичному полі, здатності до гельфільтрації, діалізу. Концентрація вільного та зв’язаного інсуліну в крові коливається у широких межах, що пов’язують з індивідуальним типом гормональної регуляції. В середньому в нормі визначається 150-200 мкод/мл вільного; 250-400 мкод/мл зв’язаного інсуліну. Імунореактивного інсуліну в крові натще 15-20 мк. між.од./мл, або 128,4±7,1 пмоль/л, після навантаження глюкозою зростає за 30 хв. до 271,2±3 пмоль/л. Зв’язок інсуліну з білками сироватки крові забезпечує постачання його до тканин. Крім цього, зв’язаний інсулін є формою зберігання гормону в крові та створює резерв його активної форми. Вільний інсулін активно стимулює поглинання глюкози м’язовою і в меншій мірі жировою тканинами. Зв’язаний інсулін є активний тільки за відношенню до жирової тканини. Визначення співвідношення вільного та зв’язаного інсуліну забезпечує нормальну життєдіяльність організму. Разом з інсуліном у кров секретується велика кількість проінсуліну і С-пептид. Концентрація С-пептиду у крові вища, ніж інсуліну, тому що він не затримується у печінці, що є діагностичним критерієм виділення інсуліну. (норма натще у сироватці крові - 0,65±0,1 нмоль/л або 0,9- 4,2 нг/л). У портальній вені проінсулін становить 5% загальної кількості інсуліноподібного компоненту, у периферичній крові - 20%.
Існує декілька транспортних інсулінактивуючих та інсуліндеградуючих ферментних систем. Інсулін руйнується в печінці та нирках ферментом глутатіон-інсулін-трансгідрогеназою (ГІТ). Останній руйнує дисульфідні мостики, роз’єднуючи a- та b- ланцюги, які в подальшому розщеплюються до амінокислот. Швидкість розпаду інсуліну пропорційна його рівню в крові, що обумовлено здатністю ГІТ адаптаційно змінювати свою активність. При голодуванні або впливі глюкагону її активність різко знижується. Період біологічного розпаду інсуліну 7-25 хв.
Інсулін швидко зникає з крові тому, що інтенсивно затримується тканинами (м’язами, нирками, печінкою). Деградація інсуліну в організмі пропорційна його концентрації в крові та посилюється гормоном росту - соматотропіном. Інсулін виділяється у незначній кількості з сечею. Його концентрація у ренальній венозній крові на 30-40% більша, ніж у артеріальній. У нирках інсулін фільтрується, реадсорбується та інактивується у епітелії проксимальних канальців.
