
- •Обмен белков
- •2. Образование аминоациладенилатов.
- •2. Образование мочевины. Орнитиновый цикл
- •Биомедицинское значение центральных метаболических путей
- •Биосинтез днк (репликация)
- •Синтез днк на матрице рнк
- •Биосинтез рнк (транскрипция)
- •Синтез и созревание рРнк и тРнк
- •Синтез рнк на матрице рнк
- •Биосинтез белков (трансляция)
- •Матричная схема биосинтеза белка
- •3. Элонгация трансляции.
- •4. Терминация трансляции.
- •Регуляция экспрессии генома
- •Генная инженерия
- •- Трансдукция.
- •Генотерапия - лечение заболеваний с помощью генов. Существует два типа генотерапии.
- •Получение трансгенных животных.
Обмен белков
На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота, поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины). У взрослого здорового человека при нормальном питании имеет место азотистое равновесие. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положителъный азотистый баланс. Часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс. Общая масса белков уменьшается.
Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. Соя – 35%, горох – 26%, мясо, рыба – 18-22%, картофель – 1,5-2%, яблоки – 0,3-0,4%.
Взрослый человек, занимающийся умственным трудом или полностью механизированным трудом, должен получать 100-120 г белка в сутки. Рабочие, выполняющие тяжелую физическую работу, - 130-150 г белка в сутки.
В организме человека синтезируются только 10 из 20 необходимых аминокислот - так называемые заменимые аминокислоты. Они могут быть синтезированы из продуктов обмена углеводов и липидов. Остальные 10 аминокислот не синтезируются в организме - незаменимые аминокислоты: валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан, фенилаланин. Аргинин и гистидин относятся к частично заменимым (взрослый организм в них не нуждается). Незаменимость аминокислот объясняется неспособностью клеток синтезировать их углеродные скелеты. Для обеспечения нормальной жизнедеятельности все эти 10 аминокислот должны поступать с пищей.
Переваривание белков начинается в желудке. Условия для переваривания: содержится активный фермент пепсин; соляная кислота.
Пепсин расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеины.
Переваривание белков завершается в верхнем отделе тонкого кишечника под действием ферментов поджелудочной железы и клеток кишечника.
Трипсин и химотрипсин наиболее активны в слабощелочной среде (рН 7,2-7,8). Благодаря гидролитическому действию на белки всех трех эндопептидаз (пепсин, трипсин, химогрипсин) образуются различной длины пептиды и некоторое количество свободных аминокислот. Помимо панкреатической карбоксипептидазы, на пептиды действуют кишечная аминопептидаза и разнообразные дипептидазы. Эластаза и коллагеназа поджелудочной железы гидролизуют соответственно эластин и коллаген.
Продукты гидролиза белков всасываются в пищеварительном тракте в основном в виде свободных аминокислот. Аминокислоты, подобно глюкозе, всасываются свободно с ионами Na+. Некоторые аминокислоты обладают способностью конкурентно тормозить всасывание других аминокислот.
Всосавшиеся аминокислоты поступают через воротную вену в печень. В печени аминокислоты участвуют не только в синтезе собственных белков и белков плазмы крови, но также в синтезе специфических азотсодержащих соединений: пуриновых и пиримидиновых нуклеотидов, креатина, мочевой кислоты, НАД и др. Значительная часть аминокислот разносится кровью по всему организму и используется для физиологических целей.
Превращения аминокислот.
Реакции по аминогруппе.
1. Дезаминирование аминокислот. Во всех случаях NH2-rpyппa аминокислоты освобождается в виде аммиака
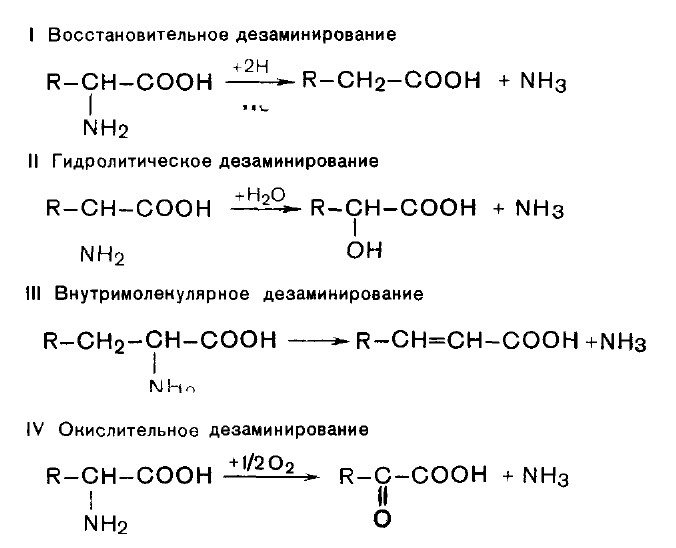
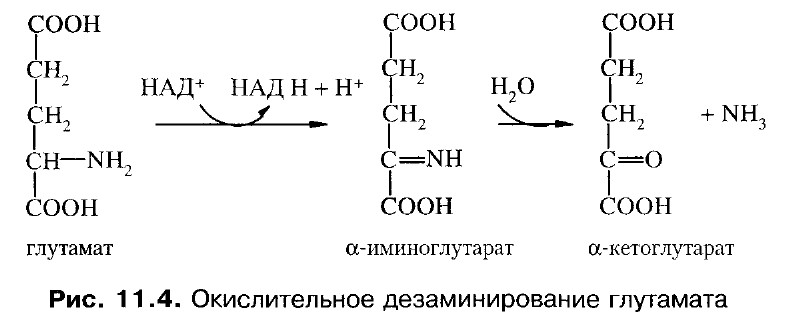
Преобладающим является окислительное дезаминирование (за исключением гистидина, подвергающегося внутримолекулярному дезаминированию). С наибольшей скоростью дезаминируется глутаминовая кислота.
2. Трансаминирование аминокислот - реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Большинство L-аминокислот дезаминируется в организме путем трансаминирования (переаминирования) с α-кетоглутаровой кислотой:
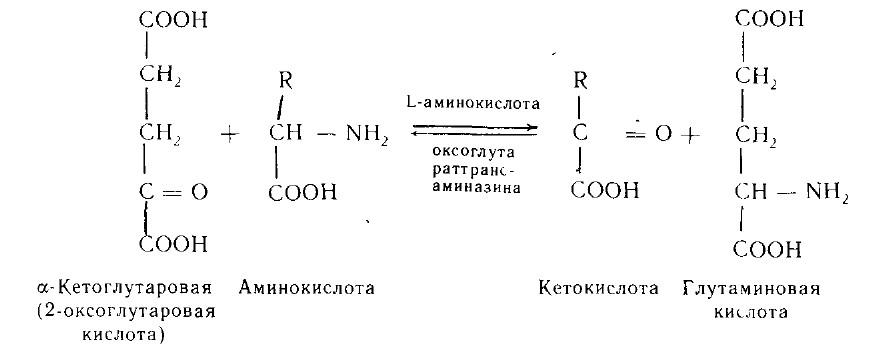
Ферменты - аминоферазы, или трансаминазы. Кофермент - пиридоксальфосфат (производное витамина В6).
Клиническое значение определения активности трансаминаз. Для клинических целей наибольшее значение имеют две трансаминазы-аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
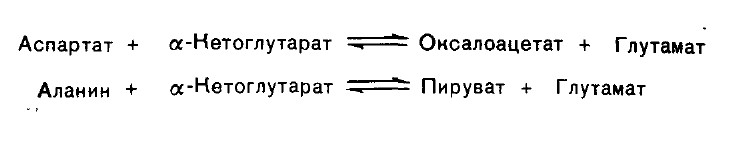
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3- 5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Повышение уровня трансаминаз в сыворотке крови отмечено при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
Реакции по карбоксильной группе.
1. Декарбоксилирование аминокислот особенно широко оно представлено у микроорганизмов. Простетической группой декарбоксилаз L-аминокислот служит пиридоксальфосфат. Продуктами декарбоксилирования аминокислот являются амины. Так как они образуются в качестве продуктов жизнедеятельности и обладают высокой физиологической активностью, их называют биогенными аминами. Открыты 4 типа декарбоксилирования аминокислот:
1.
α-Декарбоксилирование,
характерное для тканей животных.
![]()
При декарбоксилировании гистидина возникает гистамин:
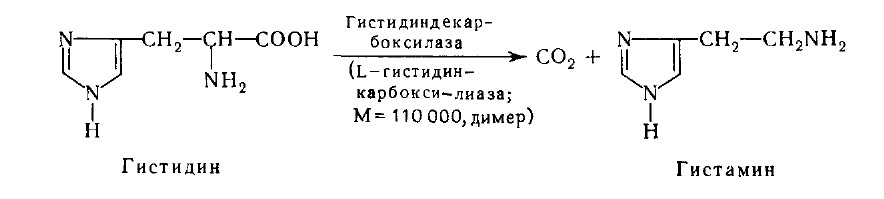
Вызывая расширение сосудов в очаге воспаления, гистамин ускоряет приток лейкоцитов, способствуя активации защитных сил организма.
Распад биогенных аминов. Накопление биогенных аминов может вызывать ряд существенных нарушений функций в организме. Амины путем окислительного дезаминирования превращаются в карбоновые кислоты:
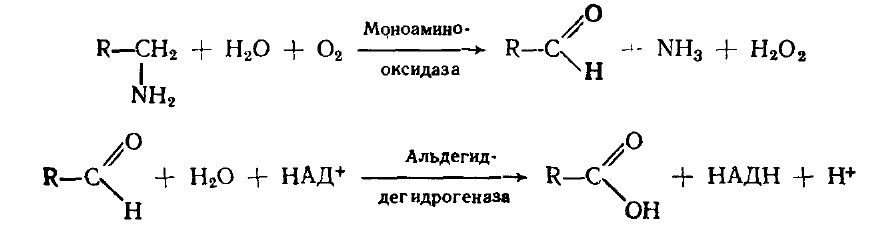
Моноаминоксидаза (ФАД-содержащий фермент) преимущественно локализуется в митохондриях. Регулирует скорость биосинтеза и распада биогенных аминов. Распад диаминов катализируют диаминоксидазы.
