
- •Усиление приливов
- •Мощность приливных течений
- •Мощность приливного подъема воды
- •Перспективные районы строительства приливных электростанций
- •Глава 14
- •Теплообменники
- •Требования к насосным агрегатам
- •Другие практические соображения
- •Глава 15
- •Введение
- •Геофизика
- •Анализ свойств сухих горных пород и естественных водоносных пластов
- •Использование геотермальных ресурсов
- •Биологическое аккумулирование
- •Химическое аккумулирование
- •Аккумулирование тепла
- •Аккумулирование электроэнергии: свинцово-кислотные
- •Топливные элементы
- •Механическое аккумулирование
- •Передача энергии
ного
аппарата появляется возможность
управлять потреблением
тепла,
снижать первоначальную температуру в
аккумуляторе или уменьшать его объем.
Как
следует из примера 16.1, запастись на три
месяца теплом для обогрева жилого дома
— вполне решаемая задача. Правда, при
этом важно не только сделать хороший
проект, но и грамотно его реализовать.
В частности, необходимо качественно
выполнить теплоизоляцию и предохранить
дом от сырости, снабдить его управляемой
системой вентиляции (возможно, с
рециркуляцией тепла), использовать
все «отходы» тепла от освещения,
приготовления пищи, жизнедеятельности
самих обитателей. Существуют примеры
подобных высокотехнологичных домов,
обладающих кроме всего прочего
прекрасной архитектурой и создающих
идеальные условие для жизни. Отметим,
что в качестве аккумулирующей тепло
среды предпочтительнее использовать
вместо воды скальные породы.
Как
следует из примера 16.1, в течение короткого
периода продолжительностью до четырех
дней сами здания можно использовать
в качестве аккумуляторов тепла. При
проектировании зданий для стран с
жарким климатом важное применение по
аналогии с созданием запасов тепла
может найти аккумулирование холода.
Известно,
что использование аккумулирования
тепла в широком масштабе высокоширотными
морскими странами позволило бы решить
проблемы снабжения теплом за счет
развития ветро- и волноэнергетики. Оба
эти источника наиболее производительны,
зимой, а их мощность, хотя и флуктуирует
час от часу, редко существенно падает
более чем на несколько дней.
Значительно
большей теплоемкостью в ограниченном
интервале температур по сравнению
с системами, использующими поглощение
тепла, обладают материалы, при изменении
температуры изменяющие фазовое
состояние. Например, глауберову соль
(Na2S04-
IOH2O)
можно использовать для аккумулирования
тепла уже при комнатной температуре.
При 32° С она разлагается на насыщенный
раствор N2SO4
с выпадением части Na2S04
в осадок. Эта реакция обратима и дает
250 кДж/кг~650 МДж/м3
тепловой энергии. Так как большая часть
стоимости аккумуляторов для обогрева
зданий связана со стоимостью конструкций,
такие аккумуляторы могут оказаться
дешевле, чем водяные емкости с более
низкой удельной плотностью запасания
энергии. К сожалению, еще не разрешены
некоторые практические трудности
при создании подобных аккумуляторов.
батареи
Электричество
— наиболее совершенная форма энергии,
и поэтому в направлении поисков
дешевых и эффективных методов
369
Аккумулирование электроэнергии: свинцово-кислотные
Рис.
16.3. Схема устройства ячейки
свинцово-кислотного
аккумулятора.
Переносчики заряда
движутся в на-
правлении, показанном
в процессе
реакции разряда через
сопротивле-
ние R.
Реакции и направление движе-
ния
носителей изменяются на обратные
при
зарядке (переключатель Si
открыт,
S2
замкнут)
его
аккумулирования делаются
огромные
усилия. Устройство,
допускающее как
поглощение,
так и выдачу
электроэнергии,
называют электрической
акку-
муляторной батареей
или элек-
трическим
аккумулятором.
Под
это определение не подпадают
устройства
с различными промежуточными носителями
энергии,
и, в частности, комбинация
электролизера и топливного
элемента.
Электрические аккумуляторы
являются существенной частью
почти
всех фотоэлектрических и небольших
ветроэнергетических
установок;
ведутся работы по созданию эффективных
аккумуля-
торов для транспортных
средств.
Хотя
многие электрохимические реакции
обратимы, только некоторые из них на
практике подходят для создания
аккумуляторов, которые допускали
бы сотни циклов при зарядно-разрядных
токах от 1 до 100 А. Наиболее известен и
широко используется свинцово-кислотный
аккумулятор, изобретенный Планте в
1860 г.
Такой
аккумулятор набирается из отдельных
элементов, схематично показанных
на рис. 16.3. Как и в любом электрохимическом
элементе, здесь имеются две
пластинки-электроды, помещенные в
проводящей раствор-электролит. В случае
свинцовокислотного аккумулятора
электроды формуются в * виде сеток,
ячейки которых заполнены пастами из
свинца и диоксида свинца. В качестве
электролита используется серная
кислота, диссоциирующая следующим
образом:
H2S04^H
+ + HSOr. (16.9)
В
процессе разряда на отрицательном
электроде идет реакция
Pb
+ HSOr-^PbSo4
+ H++2e-. (16.10)
Свинец
окисляется до РЬ2+,
сохраняющийся в виде сульфата PbS04.
Сульфат замещает свинцовую пасту в
ячейках электрода. Освобожденные в
этой реакции электроны перемещаются
по внешней цепи к положительному
электроду, где они вступают в реакцию:
Pb02
+ HS04" +ЗН+ +2e--^PbS04
+ 2H20. (16.11)
Заряд
Электролит
370
Образовавшийся
PbS04
аналогичным образом замещает РЬОг
на
положительном электроде.
Электрический ток в электролите
под-
держивается ионами Н+ и HSOr
серной кислоты, которая, та-
ким
образом, принимает участие в реакциях
на электродах.
Зная
ход реакций и соответствующие электродные
потенциа-
лы (они приведены в химических
справочниках), можно найти
теоретическую
плотность энергии, запасаемую любым
типом ак-
кумулятора.
Пример
16.2.
Теоретическая плотность энергии
свинцово-кислотного ак-
кумулятора.
Реакции (16.9) и (16.10) показывают, что
перенос 2 молей электро-
нов требует:
1
моль РЬ 207 г
моль
РЬОг 239 г
моля
H2SO4
196 г
Всего
активного материала 642 г. Но 2 моля
электронов несут заряд, равный
(2
моля) (—1,60-10—19
Кл) (6,02-1023
моль~1)
= — 1,93* 105
Кл. Стандартный
электродный потенциал
для Pb/PbS04
равен 0,30 В, а для PbS04/Pb4+
потен-
циал равен —1,62 В. Таким образом,
теоретическое значение ЭДС
элемента
(Pb/PbS04/H2S04/PbS04/Pb02)
составляет 0,3— (—1,62) = 1,92 В, при этом
(в
соответствии с международным соглашением
о знаках) электрод, на котором
нанесен
РЬ02,
считается положительным.
Реальная
ЭДС ячейки зависит от концентрации
реагентов и мо-
жет быть определена
стандартными электрохимическими
метода-
ми. Практически напряжение
на ячейке, работающей при низких
плотностях
тока, изменяется лишь на несколько
процентов от
теоретического (рис.
16.4). Обычно напряжение отдельного
эле-
мента свинцово-кислотного
аккумулятора равно 2 В. Поэтому ра-
бота,
затраченная на перемещение 2 молей
электронов, составляет
(1
• 93• 105
Кл) (2,0 В) =0,386-10® Дж,
1/,В
2,4
2,0
1,6
0
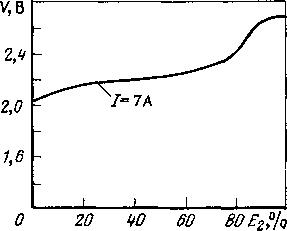
Рис.
16.4. Рабочие характеристики типового
свинцово-кислотного аккумулятора
(номинальная емкость около 100 А*ч).
Разряд. Кривые соответствуют определенным
разрядным токам (подразумеваются
постоянными) в течение «полного» разряда
(а).
Заряд. Кривые заряда при постоянном
низком значении тока (б): Е\
— процент использования запасенной
энергии; £2 — запасаемая энергия; V
—
ЭДС
ячейки
371

а
энергия, запасенная в 1
кг активных компонентов, теоретически
равна
wl=(0,386-106
Дж)/(0,642 кг) =0,60 МДж/кг.
К
сожалению, плотность энергии Wm,
запасаемой в любом реаль- ном аккумуляторе,
много ниже теоретической величины
\#7„,
так как необходимо учитывать массу
всей конструкции. Большинство коммерческих
аккумуляторов имеет Wm~0,15
W°mj
хотя от более качественных (и более
дорогих!) образцов можно вполне
обоснованно ожидать доведения Wm
до 0,25 W{m
.
В
специфическом случае свинцово-кислотного
аккумулятора основные причины столь
большого отклонения от теоретического
значения плотности энергии состоят в
том, что: 1)
реальный аккумулятор обязательно
содержит неактивные материалы, например
корпус, сепараторы (предотвращают
короткое замыкание между электродами),
воду, в которой растворена кислота
(концентрация кислоты не должна быть
слишком большой, чтобы аккумулятор не
разряжался сам на себя), и из-за этого
плотность энергии оказывается ниже
теоретической, рассчитываемой с учетом
только массы активных компонентов; 2)
нельзя допустить, чтобы реакция в
аккумуляторе шла до полного завершения.
Если весь свинец вступит в реакцию
(16.10), то не станет электрода, на котором
должна*пойти, обратная реакция, т. е.
аккумулятор не сможет работать в цикле.
Аналогично нельзя позволить концентрации
H2SO4
упасть до слишком низкого значения:
электролит перестанет быть проводником
с необходимой проводимостью. На практике
нельзя допускать, разряда аккумулятора
более чем на 50% от запасенной энергии,
в противном случае он будет разрушаться.
Такие разряды называют «глубокими
разрядами».
Описанные
ниже ограничения, присущие реальным
аккумуляторам, знакомы всем владельцам
автомобилей: они стараются до этого
дела не доводить. Твердый РЬ имеет почти
в 2 раза большую плотность, чем PbS04,
участвующий в реакциях • при разряде
(16.10). Из-за этого кристаллам PbS04
трудно занять пространство,
первоначально заполненное пастой РЬ
на отрицательном электроде. На
практике некоторое количество PbS04
оседает на дно аккумулятора при
каждом разряде. Это приводит к
невосполнимым потерям активного
вещества. Эти потери увеличиваются при
глубоком разряде. Таким образом,
аккумулятор можно достаточно быстро
довести до такого состояния, что он не
сможет заряжаться.
Другой
важный фактор, ограничивающий время
жизни даже правильно эксплуатируемого
аккумулятора,— саморазряд на
положительном электроде. Это особенно
актуально для аккумуляторов
транспортных средств, для которых сетки
электродов делаются не из чистого
свинца, а из сплава последнего с
сурьмой—более прочного и лучше
воспринимающего механические нагрузки
при движении. К сожалению, наличие
сурьмы ведет к реакции
372
