
- •1.Предмет органической химии. Теория строения органических веществ.
- •2. Задачи органической химии. Химия и народное хозяйство.
- •3.Роль химических знаний в решении современных проблем окружающей среды.
- •4.Органическая химия – химия соединений углерода.
- •5.Теория химического строения а.М. Бутлерова .
- •6.Основные положения теории органических веществ а.М. Бутлерова.
- •7.Явление изомерии. Изомеры и примеры.
- •8.Строение атома углерода. Классификация органических соединений.
- •9.Причины многообразия органических соединений.Примеры.
- •10.Типы химических связей в органических соединениях и способах их разрыва.
- •11.Предельные углеводороды. Алканы.
- •12.Метан как представитель алканов.
- •13.Приминение алканов на основе их химических свойств.
- •14. Гомологический ряд метана. Номенклатура, изомерия, физические свойства.
- •15.Основные правила написания изомеров.
- •16.Химические свойства предельных углеводородов.
- •17.Способы получения алканов и их применение.
- •18.Циклопарафины. Строение и свойства.
- •19.Углеводороды ряда этилена. Номенклатура. Изомерия. Физические свойства.
- •20.Химические свойства алкенов.
- •21.Виды изомерии алкенов.
- •22.Реакция присоединения (на примере алкенов).
- •23.Окисление алкенов перманганатом калия.Горение.
- •25.Свойства полиэтилена.
- •26.Получение и применение этиленовых углеводородов.
- •27.Диеновые углеводороды. Изомерия. Номенклатура.
- •28.Изомерия положения двойной связи.
- •28.Химические свойства диеновых углеводородов.
- •29.Получение и применение диеновых углеводородов.
- •30.Ацетилен. Гомологический ряд. Строение и физические свойства.
- •31.Химические свойства ацетиленовых.
- •32.Изомерия алкинов.
- •33.Получение и применение алкинов.
- •34.Систематическая номенклатура ацетиленовых.
- •35.Ароматические углеводороды. Бензол строение и физические свойства.
- •36. Химические свойства бензола.
28.Химические свойства диеновых углеводородов.
1)реакция присоединения:


2) Реакция полимеризации:

n CH2 = CH – CH = CH2 n – CH2 – CH – CH – CH2 - ( - CH2 – CH = CH – CH2 - )n
n CH2 = C – CH = CH2 n – CH2 – C – CH – CH2 - ( - CH2 – C = CH – CH2 - ) n
| | |
CH3 CH3 CH3
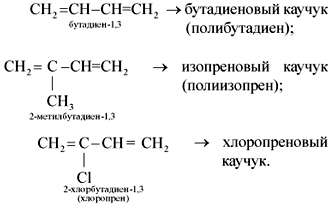
29.Получение и применение диеновых углеводородов.
Получение в промышленности:
1)Дегидрирование алканов.
CH3-CH2-CH2-CH3 t,Cr2O3,Al2O3→ CH2=CH-CH=CH2 + 2H2
бутан бутадиен-1,3 (дивинил)
2)Дегидрирование алкенов.
CH2=CH-CH2-CH3 500-600,MgO,ZnO → CH2=CH-CH=CH2 + H2
бутен-1 бутадиен-1,3
Диеновые углеводороды в основном применяются для синтеза каучуков:
30.Ацетилен. Гомологический ряд. Строение и физические свойства.
Ацетилен
– бесцветный газ, легче воздуха, немного
растворим в воде, молекулярная формула
его С2Н2.
Структурная формула:
![]() .
Атомы углерода соединены между собой
одной сигма-связью и двумя пи-связями.
Углеродные атомы ацетилена, связанные
тройной связью, находятся в состоянии
sp-гибридизации. В обычных условиях
алкины С2–С3 – газы, С4–С16 – жидкости,
высшие алкины – твердые вещества.
HC≡CH-Этин, CH3–C≡CH-пропин , СН3-СН2-
C≡CH-бутин-1 и тд.
.
Атомы углерода соединены между собой
одной сигма-связью и двумя пи-связями.
Углеродные атомы ацетилена, связанные
тройной связью, находятся в состоянии
sp-гибридизации. В обычных условиях
алкины С2–С3 – газы, С4–С16 – жидкости,
высшие алкины – твердые вещества.
HC≡CH-Этин, CH3–C≡CH-пропин , СН3-СН2-
C≡CH-бутин-1 и тд.
31.Химические свойства ацетиленовых.
1)Реакция присоединения брома:

2)Реакция присоединения водорода:

3)Реакция присоединения сложных веществ:

32.Изомерия алкинов.
Структурная изомерия
1)Изомерия положения тройной связи (начиная с С4Н6):

2)Изомерия углеродного скелета (начиная с С5Н8):

3)Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:

33.Получение и применение алкинов.
Не так давно ацетилен применялся почти исключительно в качестве горючего при газовой сварки и резке метала. Сейчас он используется для синтеза различных органических соединений.

В больших количествах используют ацетилен для получения хлорвинила.
В лабораториях и в промышленности ацетилен получают карбитным способом:

В последние годы стал применятся способ получения ацетилена из природного газа:

34.Систематическая номенклатура ацетиленовых.
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например:

35.Ароматические углеводороды. Бензол строение и физические свойства.
Соединения углерода с водородом в молекулах которых имеется бензольное кольцо или ядро относятся в ароматическим углеводородам. Общая формула СnH2n-6. Бензол – легкокипящая, бесцветная, нерастворимая в воде жидкость со своеобразным запахом. при охлаждении бензол легко застывает в белую кристаллическую массу с температурой плавления 5,5 °C. Молекулярная формула бензола С6Н6.
