
- •В ыполнение работы Экспериментальная часть
- •Расчетная часть
- •Тренировочное задание
- •Банк данных
- •Решение
- •Контрольные задачи
- •Экспериментальная часть
- •Банк данных
- •Расчетная часть
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Расчетная часть Банк данных
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Расчетная часть Банк данных
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •6. Окислительно-восстановительные реакции
- •Приборы и реактивы
- •Выполнение опыта
- •Приборы и реактивы
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные уравнения
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Опыт 2. Роль оксидной пленки в предупреждении коррозии алюминия Приборы и реактивы:
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Выполнение работы
- •Тренировочное задание
- •Решение
- •Опыт 2. Электролиз водного раствора Купрум (іі) сульфата с графитовым и медным анодом Приборы и реактивы:
- •Техника безопасности
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Опыт 2. Получение комплексных солей Приборы и реактивы:
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Список литературы
Экспериментальная часть
Приготовьте в трех пробирках раствор Натрий тиосульфата различной концентрации. Для этого внесите в каждую пробирку столько миллилитров тиосульфата и воды, сколько указано в Банке данных.
Банк данных
№ пробирки |
мл |
мл |
Общий объем, мл |
Концентрация, С |
Время протекания реакции, |
Скорость реакции, Vсек–1 |
1 |
5 |
10 |
15 |
С |
|
|
2 |
10 |
5 |
15 |
2С |
|
|
3 |
15 |
0 |
15 |
3С |
|
|
Последовательно вносите в каждую пробирку по 3 мл раствора уксусной кислоты. Фиксируйте время от момента попадания кислоты в тиосульфат до появления в растворе голубоватой опалесценции (начало выпадения осадка элементарной серы). Время протекания реакции в каждой пробирке занесите в Банк данных.
Примечание: сразу же после окончания опыта вымойте пробирки!
Расчетная часть
Учитывая зависимость
скорости от времени, затрачиваемого на
реакцию
![]() рассчитайте
скорость данной реакции при различных
концентрациях Натрий тиосульфата.
Значения занесите в Банк данных.
рассчитайте
скорость данной реакции при различных
концентрациях Натрий тиосульфата.
Значения занесите в Банк данных.
Постройте график зависимости скорости
от концентрации
![]() ,
откладывая на оси абсцисс условные
значения концентрации (С, 2С, 3С), а на оси
ординат – скорость реакции в сек.-1
(обязательно выдерживайте масштаб!).
По виду графика сделайте заключение о
характере влияния концентрации Натрий
тиосульфата на скорость взаимодействия
его с уксусной кислотой.
,
откладывая на оси абсцисс условные
значения концентрации (С, 2С, 3С), а на оси
ординат – скорость реакции в сек.-1
(обязательно выдерживайте масштаб!).
По виду графика сделайте заключение о
характере влияния концентрации Натрий
тиосульфата на скорость взаимодействия
его с уксусной кислотой.
Сделайте вывод по проделанной работе. В выводе следует отразить: а) характер зависимости скорости от концентрации реагентов; б) какой закон химической кинетики подтверждают результаты Вашей работы. Сформулируйте этот закон.
Тренировочное задание
При исследовании кинетики взаимодействия Калий хлората с Калий иодидом установлено, что при постоянной концентрации хлората и при концентрациях иодида равных 0,2 ; 0,4; 0,6 моль/л время протекания реакции соответственно равно 45 сек.,30сек, и 15 сек..
Рассчитайте скорость реакции в трех случаях. Постройте график зависимости скорости от концентрации .
Решение
Скорость любого движения (в том числе
и химического) обратно пропорциональна
времени, в течение которого это движение
происходит (самолет, поезд,
пешеход).Следовательно, рассчитать
скорость по известному времени можно
из выражения:
![]() ,
где (тау) – время
протекания процесса.
,
где (тау) – время
протекания процесса.
В соответствии с условием задачи:
![]() ;
;
![]() ;
;
![]()
для построения графика зависимости
значения
![]() умножим на 100 и получим:
умножим на 100 и получим:
![]()
График зависимости
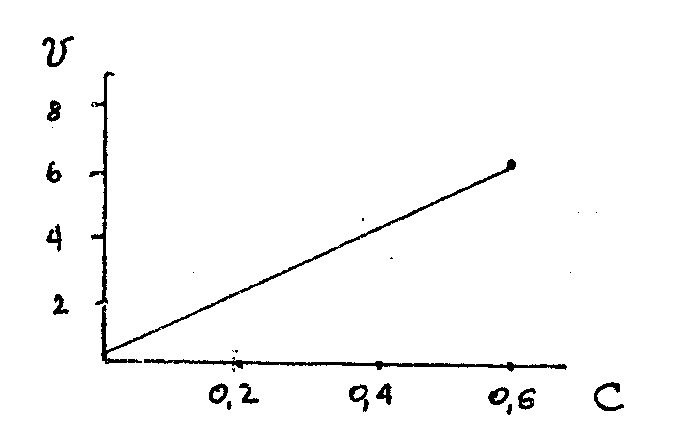
Вывод: Скорость реакции прямо пропорциональна концентрации реагентов, что подтверждает закон действия масс: при постоянной температуре и давлении скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных стехиометрическим коэффициентам (коэффициентам при формулах в уравнении реакции).
Контрольные задачи
I. Напишите кинетическое уравнение (уравнение скорости по закону действующих (действия) масс) гетерогенной реакции:
![]() .
.
Как изменится скорость реакции, если увеличить в 3 раза концентрацию СО?
2. Рассчитайте скорость гомогенной реакции, если за 15 минут протекания концентрация продукта изменилась от 0 до 0,5 моль/л.
3. Реакция между веществами выражается уравнением:
![]() .
.
Начальные концентрации составляют:
![]() моль/л,
моль/л,
![]() моль/л,
моль/л,
![]() моль/л.
Рассчитайте концентрации [A] и [B] после
того, как образовалось 0,6 моль/л вещества
С. Рассчитайте скорость реакции при
первых и вторых концентрациях. Константа
скорости данной реакции равна 0,4 л/моль·с.
моль/л.
Рассчитайте концентрации [A] и [B] после
того, как образовалось 0,6 моль/л вещества
С. Рассчитайте скорость реакции при
первых и вторых концентрациях. Константа
скорости данной реакции равна 0,4 л/моль·с.
Опыт 2. Зависимость скорости реакции от температуры. Определение температурного коэффициента реакции.
Приборы и реактивы:
Растворы: Натрий тиосульфат (0,1 н),
ацетатная (уксусная) кислота (0,1 н).
Пробирки: 20 мл, калиброванные через 5 мл,4 шт.,
10 мл, мерная, 1 шт.
Термометр спиртовой, 50°С.
Химический стакан, 0,5 л..
Электроплитка с закрытой спиралью.
Горячая вода.
Холодная дистиллированная вода.
Секундомер.
Сухое полотенце.
Техника безопасности
Погружая термометр в стакан и помешивая им воду, не делайте резких движений, чтобы не разбить термометр.
Во избежание ожога, оберните сухим полотенцем колбу с горячей водой, когда будете приливать ее в стакан для повышения температуры.

 Выполнение
опыта
Выполнение
опыта
Для достижения цели опыта, сформулированной в его названии, Вам необходимо провести в трех пробирках одну и ту же реакцию между Натрий тиосульфатом и уксусной кислотой при различных температурах.
Внешним проявлением протекания реакции является образование тонкодисперсного (очень мелкие частицы) осадка желтоватого цвета (элементарная сера).
Экспериментальная часть
Налейте в химический стакан
![]() его объема водопроводной воды. Опустите
в воду термометр.
его объема водопроводной воды. Опустите
в воду термометр.
В три пробирки внесите по 5 мл раствора
Натрий тиосульфата и по 10 мл дистиллированной
воды. В четвертую пробирку налейте
![]() ее объема уксусной кислоты.
ее объема уксусной кислоты.
Через 5 минут запишите значение температуры воды. Через каждые 30 секунд записывайте значение температуры воды до трех постоянных значений. Если температура постоянна, можно начинать выполнения опыта.
Из пробирки с уксусной кислотой, находящейся в стакане, налейте в мерную пробирку 3 мл кислоты.
Возьмите из стакана одну пробирку с тиосульфатом и вылейте в нее кислоту из мерной пробирки. Зафиксируйте время от момента попадания кислоты в тиосульфат до момента появления в пробирке голубоватой опалесценции (начало выпадения осадка серы).
Значение температуры и время внесите в банк данных. Пробирку немедленно вымойте.
Приливая в стакан горячую воду (не лейте на термометр!), по-высьте ее температуру на 10°С. Через 3 минуты проведите реакцию во второй пробирке.
Аналогичным путем повысьте температуру растворов еще на 10 градусов и проведите реакцию в третьей пробирке.
Значения температур и времени занесите в банк данных.
