
- •В ыполнение работы Экспериментальная часть
- •Расчетная часть
- •Тренировочное задание
- •Банк данных
- •Решение
- •Контрольные задачи
- •Экспериментальная часть
- •Банк данных
- •Расчетная часть
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Расчетная часть Банк данных
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Расчетная часть Банк данных
- •Тренировочное задание
- •Решение
- •Контрольные задачи
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •6. Окислительно-восстановительные реакции
- •Приборы и реактивы
- •Выполнение опыта
- •Приборы и реактивы
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные уравнения
- •Тренировочное задание
- •Решение
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Опыт 2. Роль оксидной пленки в предупреждении коррозии алюминия Приборы и реактивы:
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Выполнение работы
- •Тренировочное задание
- •Решение
- •Опыт 2. Электролиз водного раствора Купрум (іі) сульфата с графитовым и медным анодом Приборы и реактивы:
- •Техника безопасности
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Тренировочное задание
- •Решение
- •Опыт 2. Получение комплексных солей Приборы и реактивы:
- •Выполнение опыта
- •Тренировочное задание
- •Решение
- •Контрольные задания
- •Список литературы
Тренировочное задание
Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций методом электронного баланса.
1.
![]() .
.
2.
![]() .
.
3.
![]() .
.
Решение
При составлении уравнений окислительно-восстановительных реакций следует учитывать:
1. Окислительно-восстановительные реакции – это реакции, в ходе которых происходит изменение степеней окисления элементов окислителя и восстановителя.
2. Степень окисления – это условный
заряд, который приобретает атом, отдавая
или принимая электроны. Исходя и того,
что заряд электрона
![]() атом, который принимает n электронов
приобретает заряд
атом, который принимает n электронов
приобретает заряд
![]() ,
атом, который отдает n электронов,
приобретает заряд
,
атом, который отдает n электронов,
приобретает заряд
![]() .
.
3. Атомы, а также молекулы простых и
сложных веществ зарядов не имеют.
Например:
![]() .
.
4. В молекулах сложных веществ (соединений) число зарядов положительных всегда равно числу зарядов отрицательных. Например:
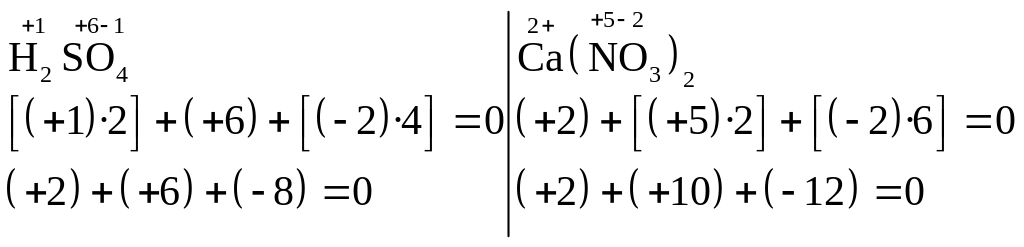
5. Начинать расчет степеней окисления элементов в соединениях следует с тех элементов, которые имеют постоянные степени окисления:
а) элементы главных подгрупп І, ІІ и ІІІ
групп Периодической системы элементов
Д.И. Менделеева имеют всегда положительные
степени окисления, численно равные
номеру группы, в которой находятся.
Гидроген только в соединениях с металлами
(гидридах) может иметь степень окисления
.
Например:
![]() .
Во всех остальных соединениях гидроген
имеет степень окисления
.
Во всех остальных соединениях гидроген
имеет степень окисления
![]() ;
;
б) Оксиген во всех соединениях имеет
степень окисления
![]() ,
кроме пероксидов, в которых его степень
окисления
.
Например:
,
кроме пероксидов, в которых его степень
окисления
.
Например:
![]() – пероксиды.
– пероксиды.
6. При расчете степеней окисления элементов, имеющих переменные степени окисления, следует учитывать, что степень окисления – это заряд одного атома данного элемента. Сумма всех зарядов (положительных и отрицательных) должна быть равна нулю. Из этого равенства легко находится неизвестная степень окисления одного из элементов. Например:
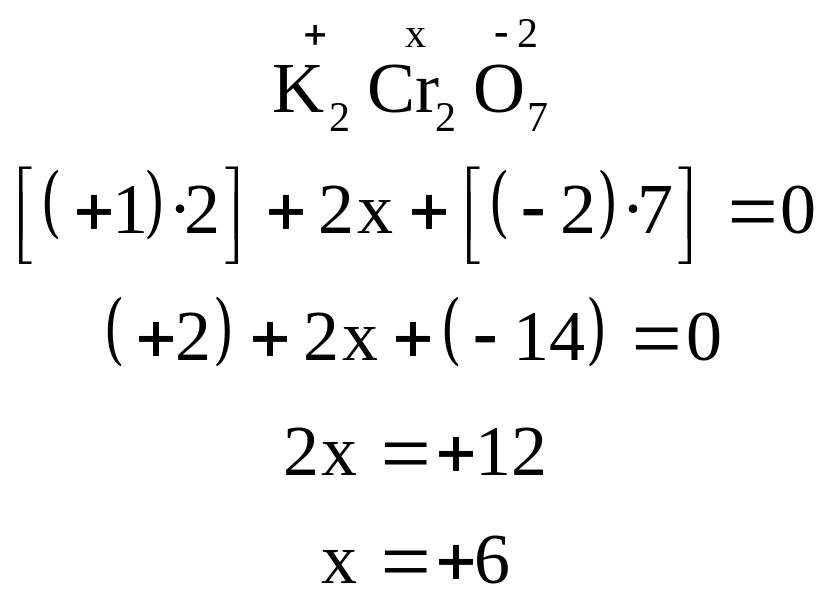
7. Заряды ионов кислотных остатков всегда
отрицательны и равны числу атомов
водорода в молекуле кислоты. Например,
в
![]() заряд кислотного остатка
заряд кислотного остатка
![]() ;
в
заряд кислотного остатка
;
в
заряд кислотного остатка
![]() .
.
8. При переходе кислотного остатка из
одного соединения в другое степень
окисления кислотообразующего элемента
не изменяется. Например:
![]() .
.
9. Определив степени окисления всех элементов в уравнении реакции, отыщите те элементы, степени окисления которых изменились в ходе реакции.
10. Составьте для этих элементов электронные уравнения.
11. Путем выставления первичных коэффициентов, создайте электронный баланс (число электронов, отданных одним элементом должно быть равно числу электронов, принятых другим элементом).
12. Проверьте по уравнению возможность реализации первичных коэффициентов в виде чисел атомов соответствующих элементов.
13. Уравняйте число атомов элементов, изменивших степени окисления, посредством расстановки коэффициентов.
14. Уравняйте число атомов металлов (или кислотных остатков).
15. Уравняйте число атомов Гидрогена.
16. Посчитайте сумму атомов Оксигена в левой и правой частях уравнения. Равенство сумм указывает на корректное составление уравнения.
17. С учетом того, что процесс окисления сопровождается отдачей электронов, а процесс восстановления их присоединением, определите окислитель и восстановитель.
Уравнение реакции №1
![]()
![]()
Уравнение №2
![]()
![]()
Атом Арсена, не имеющий заряда, в ходе
реакции отдает 5 электронов, степень
его окисления возрастает
![]() .
Следовательно, он окисляется, являясь
восстановителем.
.
Следовательно, он окисляется, являясь
восстановителем.
Атом Нитрогена в молекуле нитратной
кислоты имеет степень окисления
,
а в молекуле оксида
![]() .
Следовательно, он принял 3 электрона,
т.е. восстановился, выполнив роль
окислителя.
.
Следовательно, он принял 3 электрона,
т.е. восстановился, выполнив роль
окислителя.
Уравнение реакции №3
![]()
![]()
В соответствии с первичными коэффициентами электронного баланса число атомов Хрома, участвующих в реакции, должно быть 3, а атомов Иода 1. Однако, при проверке возможности реализации первичных коэффициентов в виде числа атомов этих элементов (см. пункт 12) оказывается, что в реакции должно участвовать минимум по 2 атома каждого из этих элементов, либо их число кратное двум. В подобных случаях первичные коэффициенты удваиваются. Полученные значения являются числами атомов соответствующих элементов в уравнении реакции.
В этой реакции атом Хрома
![]() принимает электроны и восстанавливается,
являясь окислителем. Атом Иода
отдает электроны и окисляется, являясь
восстановителем.
принимает электроны и восстанавливается,
являясь окислителем. Атом Иода
отдает электроны и окисляется, являясь
восстановителем.
Вывод. Окислитель – это атом (молекула, содержащая атом), способный принимать электроны. Восстановитель – это атом (или молекула, содержащая атом), способный отдавать электроны.
