
- •1. Початкові поняття атомно-молекулярного вчення
- •2. Основні атомно-молекулярні одиниці вимірювання
- •Відносна атомна маса Ar
- •Відносна молекулярна маса Мr
- •Молярна маса м (г/моль)
- •3. Характеристика складових частин атому
- •5. Моль речовини
- •7Закон Авогадро (1811 р.) у рівних об`ємах різних газів при однакових температурі та тиску міститься однакова кількість молекул . Закон Авогадро та висновки з нього
- •Така її вагова кількість, яка без залишку взаємодіє з одним еквівалентом будь-якої іншої речовини
- •Еквівалентна маса кислоти
- •Еквівалентна маса основи
- •Еквівалент оксиду
- •Еквівалент солі
- •Еквівалентна маса елементу
- •55,847 Ферум
- •17. Валентні властивості атомів (валентність, ступінь окиснення, енергія іонізації, спорідненість до електрона, електронегативність)
- •18. Типи хімічного зв`язку
- •Неполярний: н2, Сl2, n2
- •20. Іонний, металічний, водневий зв’язки
- •2 Неорганічні речовини 1. Типи неорганічних речовин
- •2Бінарні оксигеновмісні сполуки 2. Оксиди
- •З Розчинні (луги) koh, CsOh, NaOh Нерозчинні Cu(oh)2, Mn(oh)2 а розчинністю у воді на:
- •Номенклатура основ
- •26. Типи хімічних реакцій
- •2 Розчини – гомогенні дисперсні системи, які складаються з розчинника, розчинюваної речовини та продуктів їх взаємодії 8. Розчини
- •34. Вимоги до реакцій в аналітичній хімії
- •38. Осадження – найважливіша операція гравіметрії
- •Вимоги до реакцій в титриметричних методах
- •41. Основи кислотно-основного титрування
- •Трилоно-метрія
- •43. Вода. Визначення твердості води
- •44. Твердість води та способи її усунення
- •45. Електроліти і неелектроліти
- •46. Теорія електролітичної дисоціації
- •47. Іонний добуток води. РН розчину
- •55. Гідроген. Вода. Отримання, властивості, застосування
- •56. До хімії ядерно-паливних матеріалів
- •57. Ядерне паливо
- •58. Дія випромінювання на метали
- •60. Кристалографічні особливості металів
- •60. Приклад застосування конструкційного матеріалу Цирконію – Zr у ядерній енергетиці
- •66. Полімери. Фізико-хімічні властивості. Застосування
- •67. Властивості і найважливіші характеристики полімерів.
60. Кристалографічні особливості металів
Щільність упаковки представляє собою відношення сумарного об”єму, що займають атоми в кристалічній решітці, до її повного об”єму. Різні типи кристалічних решіток мають різну щільність упаковки атомів. В ГЦК-решітці атоми займають 74% всього об”єму решітки, а міжатомні проміжки (пори) 26%. В ОЦК-решітці атоми займають 68% всього об”єму, а пори – 32%. Компактність решітки залежить від особливостей електронної структури металів і характеру зв”язку між атомами. Від типу кристалічної решітки сильно залежать властивості металу. Упорядкованість кристалічної будови в просторовій решітці дозволяє виділити окремі кристалографічні напрями і площини. Кристалографічні напрями – це характерні прямі лінії, що визодять із точки відліку, вздовж яких в крис-талічній решітці розташовуються атоми. Точками відліку можуть слугувати вершини кубу, кристалографічними напрямами – його ребра, діагоналі, і діагоналі граней.
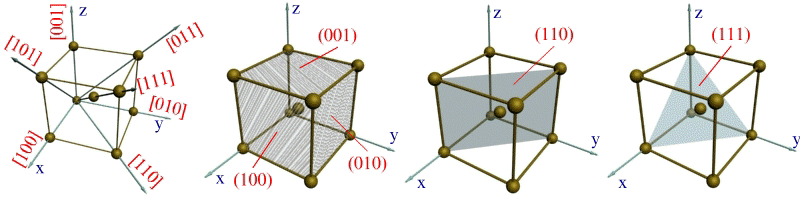
Кристалографічні напрями і площини в кристалічній решітці: а) - основні напрями і
їх позначення; б), в), г) - основні площини і їх позначення
Під анізотропією треба розуміти неоднаковість механічних і інших властивостей в кристалічних тілах вздовж різних кристалографічних напрямах. Вона є природнім слідством кристалічної будови, бо на різних кристалографічних площинах і вздовж різних напрямів щільність атомів різна. Оскільки механічні, фізичні і хімічні властивості вздовж різних напрямів залежать від щільності розташованих на них атомів, то перераховані властивості вздовж різних напрямів в кристалічних тілах повинні бути неоднаковими.
Анізотропія виявляється тільки в межах одного монокристалу або зерна-кристаліта. В полікристалічних тілах вона не спостерігається завдяки усеред-ненню властивостей по кожному напряму для великої кількості зерен, що вільно орієнтовані одне відносно другого. Тому реальні метали є квазі-ізотропними, тобто псевдоізотропними.
60. Приклад застосування конструкційного матеріалу Цирконію – Zr у ядерній енергетиці
Хімічний елемент IV групи періодичної системи (п.н. 40, ат. в. 91,22). До складу природного Ц. входять ізотопи: Zr90 (51,46%), Zr91 (11,23%), Zr92 (17,11%), Zr94 (17,40%), Zr96 (2,80%). Конфігурація зовнішніх електронів атому 4d25s2. Вміст Ц. у земній корі складає 2 10-2 ваг. %.
Компактний Ц. – в хімічно чистому вигляді виключно ковкий та плас-тичний. Ц. утворює дві модифікації: низькотемпературну α- Zr з гексагон-нальною решіткою і високотемпературну β- Zr з об”ємно-центрованою кубічною решіткою. Перехід α β відбувається при 862 ± 2о. Температура переходу підвищується при розчиненні в Ц. елементів O, N, C, Al, Hf i Sn; більшість інших елементів зменшує її. На твердість Ц. сильно впливає вміст кисню; так, при О2 > 0,2 % цирконій не піддається холодній обробці тиском. Одна з найбільш цінних властивостей Ц. – його значна стійкість проти коро-зії в хімічно агресивних середовищах. Металічний Ц. розчиняється в плави-ковій і в гарячій концентрованій сірчаній кислотах, в „царській горілці” і в розплавлених фторидах лужних металів і не розчиняється в соляній і азотній кислотах та в розчинах луг. У водних розчинах сполуки Ц. характеризу-ються високим ступенем гідролізу, утворенням полімерів і комплексних іонів.
В сполуках Ц. чотирьохвалентний. В особливих умовах були отримані галогеніди і органічні спо-луки Ц., в яких він проявляє валентність 3, 2, 1 і 0. Величина стандартного потенціалу Ц. для реакції Zr0 + 2Н2О ZrО2 + 4Н+ + 4е- дорівнює -1,43 в.
У повітрі металічний цирконій вкривається плівкою оксиду. Інтенсина взаємодія Ц. з киснем повітря починається при нагріві до 200 оС, але дрібно диспергований порошок металу є пірофорним і займається при звичайній темпратурі. Ц. може розчиняти до 60 ат.% кисню без зміни металічної структури. При подальшому поглинанні О2 утворюється діоксид ZrО2. При 300-800 оС порошковий Ц. швидко абсорбує водень з утворенням п”яти кристалічних фаз: (Zr2Н, ZrН, ZrН2 і др.) з металічним зв”язком; гідриди легко розкладаються і водень можна видалити вакуумуванням з нагрівом. Азот починає реагувати з порошком Ц. з 400 оС, вище 800 оС реакція значно пришвидшується. При цьому метал поглинає до 20 ат.% азоту, утворюючи твердий розчин, який не розкладається в процесі термічної вакуумної обробки і при дії кальцію. Подальше поглинання азоту металом веде до утво-рення нітриду ZrN, який при 8,9 К характеризується надпровідністю.
Найбільш високоплавкою сполукою Ц. є карбід, який отримується при взаємодії оксиду металу з карбоном при 2000 оС. Карбід Ц. дуже стійкий, не реагує з водою при нагріванні; розчиняється у фтористоводневій кислоті, концентрованих сірчаній і азотній кислотах та в „царській горілці”. У по-вітрі при 700 оС згорає з утворенням ZrО2. З бором Ц. реагує лише при нагріванні вище 1500 оС; при цьому утворюється декілька боридів, виключно тугоплавких.
Основне застосування металічний цирконій, очищений від гафнію, знахо-дить як конструкційний матеріал в ядерній енергетиці; це обумовлено малим поперечним перетином захоплення теплових нейтронів і високою корозійною стійкістю сплавів Ц. з деякими легуючими домішками у воді. Крім цього, Ц. використовують в електровакуумній техніці, металургії (легуючий елемент), в хімічному машинобудуванні. Сплави цирконію. Елементи, які утворюють з Zr тверді розчини, змінюють температуру α ↔ β пере-ходу гексагональної щільно упакованої структури в кубічну об”ємно центровану з відповідним роз-ширенням або звуженням області α- або β-твердих розчинів. Це дозволяє легуванням і термічною обробкою отримувати однофазні або двозфазні цирконієві сплави з різними фізико-хімічними властивостями. Сплави цирконію поділяють на 5 типів: - Ц.с. з переважанням α-твердого розчину (підвищення температури α ↔ β переходу), наприклад Zr – Al, Zr – Sn, Zr – O, Zr – N - Ц.с. з переважанням β-твердого розчину (зменшення температури α ↔ β переходу), наприклад Zr – Nb, Zr – Ta, Zr – Th, Zr – U - Ц.с. з евтектичним або евтектоїдним характером діаграм стану (типу Fe – Fe3C), напр., Zr – Ag, Zr – Be, Zr – Co, Zr – Cr, Zr – Cu, Zr – Fe, Zr – Mn, Zr – Mo, Zr – Ni, Zr – V, Zr – W, Zr – H; - Ц.с. з повною розчинністю в твердому стані, напр., Zr – Hf, Zr – Ti; - Комбінації першого і третього, або другого і третього типів, напр., Zr – C, Zr – Ge, Zr – Si. Найбільш широко використовуються Ц.с. в ядерній енергетиці у зв”язку з їх малим ефективним перетином захоплення теплових нейтронів, механічною міцністю при підвищених температурах (до 550-600 оС), високою корозійною стікістю при високих температурах у водних, лужних і в деяких кислих середовищах. До такого роду Ц.с. відносяться „циркалої” (1,3 – 1,6 % Sn, 0,07 - 0,2 % Fe, 0,05 – 0,16 % Cr, 0,03 – 0,08 % Ni, останнє Zr), які мають високу міцність (до 40 кг/мм2 при 500 оС), твердість по Брюнелю 180-210 кг/мм2, теплопровідність, що практично не змінюється до 400 оС, і характеризуються високою стійкістю у воді при підвищених температурах. Як конструкційний матеріал для атомних реакторів використовують також так звані „озгеніти” – Ц. с. із загальним вмістом Sn, Fe, Ni, Nb 0,5 – 1,5 % , корозійно стійкі у гарячій воді і парі до 400 оС, і інші сплави, які звичайно отримують легуванням цирконію молібденом, ніобієм, танталом, нікелем або гафнієм, що підвищує їх механічні властивості. До Ц.с. можуть бути віднесені також різні тугоплавкі сполуки цирконію – карбід, борид, нітрид, силіцид, які використовують в різних галузях техніки в зв”язку з високими температурами плавлення, низьким тиском пари, високою твердістю і стійкістю до агресивних речовин.
61. Основні поняття органічної хімії . Карбон (вуглець) виділяється серед всіх елементів тим, що його атоми можуть з”єднуватися один з одним в довгі ланцюги або цикли. Саме ця властивість дозволяє карбону створювати мільйони сполук, вивченню яких присвячена ціла область – органічна хімія. Декілька причин сприяли проявленню карбоном таких властивостей. Доведено, що енергія зв”язку С – С (міцність зв”язку) може бути порівнена з міцністю зв”язків С – О. Вуглець має можливість виявляти не один, а три різновиди гібридизації орбіталей: у випадку sp3- гібридизації утворюється чотири гібридних орбіталі, що мають тетраедричну орієнтацію; з їх допомогою створюються прості ковалентні зв”язки. У випадку sp2- гібридизації утворюються три гібридні орбіталі, орієнтовані в одній площині, і за їх допомогою створюються подвійні кратні зв”язки. Зрештою, за допомогою двох sp-гібридизованих орбіталей, що мають лінійну орієнтацію, між атомами карбону виникають потрійні кратні зв”язки. Добре відомо, що атоми карбону здатні утворювати прості, подвійні і потрійні зв”язки не тільки одне з одним, але і з іншими елементами.
Теорія хімічної будови А.М.Бутлєрова (іноді її називають структурною): 1)атоми в молекулах з”єднані між собою в певному порядку хімічними зв”язками згідно з їх валентністю ; 2)властивості речовини визначаються не лише якісним складом, але і її будовою , взаємним впливом атомів, як зв”язаних між собою хімічними зв”язками, так і не зв”язаних безпосередньо ; 3)будова молекул може бути визначена на основі вивчення їх хімічних властивостей. Важливим наслідком цієї теорії був висновок про те, що кожна органічна сполука повинна мати одну хімічну формулу, що відображає її будову. Такий висновок є теоретичним обгрунтуванням добре відомого вже тоді явища ізомерії – існування речовин з однаковим молекулярним складом, але з різними властивостями.
62. Класифікація органічних сполук. Для класифікації органічних сполук за типами і побудови їх назв в молекулі органічної сполуки прийнято виділяти вуглецевий скелет і функціональні групи. Карбоновий скелет представляє собою послідовність хімічно зв”язаних один з одним атомів вуглецю. Функціональні групи утворюють всі атоми, крім гідрогену,або групи атомів, які зв”язані з атомом карбону . Типи карбонових скелетів. Карбонові скелети розподіляють на ациклічні (що не містять циклів), циклічні і гетероциклічні. В гетероциклічному скелеті в карбоновий цикл включається один або декілька атомів, відмінних від карбону. Такі гетероатоми розглядають не як функціональні групи, а вважають їх частиною карбонового скелету.

В самих карбонових скелетах треба класифікувати окремі атоми карбону за числом хімічно зв”язаних з ними атомів карбону. Якщо даний атом карбону зв”язаний з одним атомом карбону, то його називають первинним, з двома – вторинним, трьома – третинним, з чотирма – четвер-тинним. Оскільки атоми карбону можуть утворювати між собою не тільки одинарні, але і кратні (подвійні і потрійні) зв”язки, то сполуки, що містять тільки одинарні зв”язки С – С , називають насиченими, сполуки з кратними карбон – карбоновими зв”язками – ненасиченими. Сполуки, в яких атоми карбону зв”язані тільки з атомами гідрогену, називають вуглеводнями. Вуглеводні визнані родоначальними в органічній хімії. Різноманітні сполуки розглядаються як похідні вугле-воднів, отримані введенням в них функціональних груп . Функціональні групи. Більшість органічних сполук, окрім атомів карбону і гідрогену, містять атоми інших елементів (що не входять до скелету). Ці атоми або їх групи, які багато в чому визначають хімічні і фізичні властивості органічних сполук, називають функціональними групами. За ознакою таких груп сполуки відносяться до того, чи іншого класу. Гомологічний ряд – це поняття дуже корисне для опису органічних сполук. Гомологічний ряд утворюють сполуки, які відрізняються одна від одної на групу —СН2— і мають подібні хімічні властивості. Групи СН2 називаються гомологічною різницею. Прикладом гомологічного ряду може бути ряд насичених вуглеводнів (алканів). Простіший представник – метан СН4. Гомологами метану є: етан С2Н6, пропан С3Н8, бутан С4Н10, пентан С5Н12, гексан С6Н14, гептан С7Н16 і т. д. Формула любого наступного гомологу може бути отримана додаванням гомологічної різниці до формули попереднього вуглеводня. Розглянутий гомологічний ряд насичених вуглеводнів описується загальною формулою СnН2n+2, де п — число атомів вуглеводню.
63. Номенклатура органічних сполук. В наш час є визнаною систематична номенклатура IUРАС (Міжнародний союз теоретичної та прикладної хімії). Серед її варіантів найбільш розповсюдженою є замісна номенклатера: в сполуці виділяється певна основа, в якій здійснено заміщення атомів гідрогену на інші атоми або групи. Правила IUРАС дозволяють використовувати назви органічних сполук, що побудовані на основі застарілих тривіальної та раціональної номенклатур. За цими правилами назва органічної сполуки складається із назви головного ланцюгу, що утворює корінь слова, і назв функцій, які використовують в якості приставок або суфіксів. Для правильної побудови назви треба провести вибір головного ланцюгу і нумерацію атомів карбону в ньому. Замісник – це будь-який атом, або група атомів, які заміщують атом гідрогену в родоначальній структурі. Функціональна група – це атом або група атомів невуглеводневого характеру, які визначають належність сполуки до певного класу. Характеристична група — це функціональна група, яка зв”язана з родоначальною структурою. Утворення назви органічної сполуки. Основу назви сполуки складає корінь слова, яке позначає насичений вуглеводень з тим же самим числом атомів, що і головний ланцюг(мет-, ет-, проп-, бут-, пент-, гекс- і т.д.). Після цього йде суфікс, що характеризує ступінь насиченості, -ан, якщо в молекулі немає кратних зв”язків, -ен при наявності подвійних зв”язків та –ин для потрійних зв”язків (наприклад ентан, пентен, пентин). Якщо кратних зв”язків в молекулі декілька, то в суфіксі зазначають число таких зв”язків: -діен, -триен, а після суфіксу обов”язково арабськими цифрами вказується положення кратного зв”язку (наприклад, бутен-1, бутен-2, бутадіен-1,3):
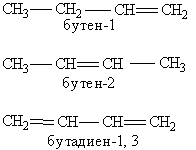
Далі в суфікс виноситься назва найстаршої характеристичної групи в молекулі і відмічається її положення цифрою. Інші замісники зазначають за допомогою приставок. Положення замісника відображається цифрою перед приставкою, наприклад: 3-метил; 2-хлор і т.п. Якщо в молекулі є декілька однакових замісників, то перед назвою відповідної групи їх кількість вказують словом (діметил-. трихлор- і т.д.). Вуглеводневі радикали мають свої назви.
В
якості прикладу наведемо наступну
сполуку:

1) Вибір ланцюгу однозначний; отже, корінь слова – пент; далі йде суфікс –ен, який вказує на наявність кратного зв”язку; 2) порядок нумерації забезпечує старшій групі (-ОН) найменший номер; 3) повна назва сполуки закінчується суфіксом, що означає старшу групу (в даному випадку суфікс –ол вказує на наявність гідроксильної групи); положення подвійного зв”язку і гідроксильної групи вказується цифрами. Отже, наведена сполука називається пентен-4-ол-2.
64. Реакції полімерізації. Особливим типом реакцій приєднання до алкенів є їх полімерізація, яка може каталізуватися як електрофілами, так і радикалами або сполуками перехідних металів. Реакція полімерізації – це послідовне приєднання молекул ненасичених сполук одна до одної з утворенням високо-молекулярного продукту – полімера. Молекули алкена, які вступають в реак-цію полімерізації – мономери. Число елементарних ланок, які повторюються в макромолекулі, називається ступінню полімерізації (n). В залежності від ступеню полімерізації з одних і тих же мономерів можна отримувати речови-ни з різними властивостями. Так, поліетилен з короткими ланцюгами (n = 20) є рідиною, що має мастильні властивості. Поліетилен з довжиною ланцюгу в 1500-2000 ланок представляє собою твердий, але гнучкий пластичний мате-ріал, із якого можна отримувати плівки, виготовляти пляшки і іншу посуду, еластичні труби та ін. Нарешті, поліетилен з довжиною ланцюгу 5-6 тис. ланок є твердою речовиною, із якої можна виготовляти литі вироби, жорсткі труби, міцні нитки.
Якщо в реакції полімерізації приймає участь невелика кількість молекул, то утворюються низькомолекулярні речовини, наприклад дімери, тримери і т.ін. Умови перебігу реакцій полімерізації доволі різоманітні. В деяких випадках потрібні каталізатори і високий тиск. Але головним фактором є будова молекули мономеру. В реакцію полімерізації вступають ненасичені сполуки за рахунок розриву кратних зв”язків.
 Полімерізація
– це ланцюгова реакція
і для того, щоб вона розпочалася, необхідно
активувати молекули мономеру за допомогою
так званих ініціа-торів. Таким ініціаторами
реакції можуть бути вільні радикали
або іони (катіони, аніони). В
залежності від природи ініціатору
розрізняють ради-кальний, катіонний
або аніонний механізми полімерізації.
Найбільш розпо-всюджені полімери
вуглеводневої природи – поліетилен і
поліпропілен.
Полімерізація
– це ланцюгова реакція
і для того, щоб вона розпочалася, необхідно
активувати молекули мономеру за допомогою
так званих ініціа-торів. Таким ініціаторами
реакції можуть бути вільні радикали
або іони (катіони, аніони). В
залежності від природи ініціатору
розрізняють ради-кальний, катіонний
або аніонний механізми полімерізації.
Найбільш розпо-всюджені полімери
вуглеводневої природи – поліетилен і
поліпропілен.
Застосування деяких полімерів
Полівінілхлорид
—
продукт полімерізації хлористого вінілу
(вінілхлорида) СН2=СНCl.
Структурна формула:
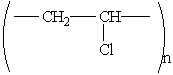
Цей полімер має цінні властивості: він негорючий, стійкий до дії хімічних реагентів, легко забарвлюється. Із пластмас на його основі виготовляють клеєнки, плащі, портфелі, штучну шкіру для взуття і ін. Широко застосову-ється для ізоляції проводів і кабелів.
Тефлон — продукт полімерізації тетрафторетилену:
![]() Це
найінертніша органічна речовина (на
неї діють лише розплавлені калій і
натрій). Відрізняється високою морозо-
і теплостійкістю.
Полістирол
- тверда прозора пружна речовина.
Отримується полімерізацією стиролу.
Структурна формула:
Це
найінертніша органічна речовина (на
неї діють лише розплавлені калій і
натрій). Відрізняється високою морозо-
і теплостійкістю.
Полістирол
- тверда прозора пружна речовина.
Отримується полімерізацією стиролу.
Структурна формула:
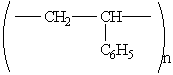
Полістирол широко використовується в якості діелектрика в електро- і радіотехніці. Йде на виготовлення кислототривких труб, тари, а також побутових виробів. Із нього готують легкі пористі пластмаси – пінопласти.
65. Ароматичні вуглеводні (арени)
Ароматичними вуглеводнями (аренами) називаються речовини, в молеку-лах яких міститься одне або декілька бензольних кілець – циклічних груп атомів карбону з особливим характером зв”язків. Поняття „бензольне кільце” потребує розшифровки. Перша структура бензолу була запропонована у 1865 р. німецьким вченим А.Кекуле:

Ця формула правильно відображає рівнозначність шести атомів карбону, але не пояснює ряд особливих властивостей бензолу. Наприклад, не дивлячись на ненасиченість, бензол не виявляє схильності до реакцій приєднання: він не знебарвлює бромну воду і розчин перманганату калію, тобто не дає типових для ненасичених сполук якісних реакцій. Особливості будови і властивостей бензолу вдалося повністю пояснити тільки завдяки розвитку сучасної кван-тово - механічної теорії хімічних зв”язків. Згідно з сучасними уявленнями, всі шість атомів карбону в молекулі бензолу знаходяться в sp2-гібридному стані. Кожний атом карбону утворює -зв”язки з двома іншими атомами карбону і одним атомом гідрогену, які лежать в одній площині. Валентні кути між трьома -зв”язками дорівнюють 120о. Таким чином, всі шість атомів карбону лежать в одній площині, утворюючи правильний шестикутник ( -скелет молекули бензолу). Кожний атом карбону має одну негібридизовану р- орбіталь. Шість таких орбіталей розміщуються перпендикулярно плос-кому -скелету і паралельно одна одній (див. рис.а). Всі шість електронів взаємодіють між собою, утворюючи -зв”язки, не локалізовані в пари як при утворенні подвійних зв”язків, а об”єднані в єдину -електронну хмару. Таким чином, в молекулі бензолу відбувається кругове спряження. Найбільша -електронна щільність в цій спряженій системі розташовується над і під площиною -скелету:
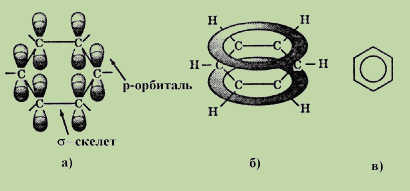
В результаті всі зв”язки між атомами карбону в бензолі мають довжину 0,139 нм. Ця величина є проміжною між довжиною одинарного зв”язку в алканах (0,154 нм) і подвійного зв”язку в алкенах (0,133 нм). Рівнозначність зв”язків прийнято зображати кружком всередині циклу (див. рис. в). Кругове спряження дає виграш в енергії 150 кДж/моль. Ця величина складає енергію спряження – кількість енергії, яку потрібно витратити, щоб порушити ароматичну систему бензолу. Така електронна будова пояснює всі особли-вості бензолу. Так, зрозуміло чому бензол важко вступає в реакції приєднан-ня, - це привело б порушення спряження. Такі реакції можливі лише в дуже жорстких умовах.
Умовно арени можна розділити на два ряди. До першого відносять похідні бензолу (наприклад, толуол чи діфеніл), до другого – конденсовані (поліядерні) арени (простіший з них – нафталін):

Гомологічний ряд бензолу відповідає загальній формулі С6Н2n-6. Структурна ізомерія в гомологічному ряду бензолу обумовлена взаємним розташуванням замісників в ядрі. Моно-заміщені похідні бензолу не мають ізомерів положе-ння, бо всі атоми в бензольному ядрі рівнозначні. Дізаміщені похідні існують у вигляді трьох ізомерів,

які відрізняються взаємним розташуванням замісників. Положення заміс-ників вказують цифрами або приставками: орто- (о-), мета- (м-), пара- (п-). Радикали ароматичних вуглеводнів називають арильними радикалами. Радикал С6Н5 — називається феніл.
Фізичні властивості. Перші члени гомологічного ряду бензолу (наприклад, толуол, етилбензол і др.) – безбарвні рідини із специфічним запахом. Вони легше води і нерозчинні в ній. Добре розчиняються в органічних розчинни-ках. Бензол та його гомологи самі є добрими розчинниками для багатьох органічних речовин. Всі арени горять кіптявим полум”ям завдяки високому вмісту карбону в їх молекулах.
