
- •4.Застосування сульфуру
- •2) Взаємодія з неметалами
- •2)Взаємодія з неметалами:
- •2)Взаємодія з неметалами:
- •26.Промисловий синтез аміаку
- •27.Характеристика Карбону за місцем його у періодичній системі.
- •28.Застосування сульфатної кислоти
- •29.Характеристика Силіцію за місцем його у періодичній системі.
- •30.Алотропія Карбону
- •31.Характеристика Брому за місцем його у періодичній системі.
- •32.Фізичні властивості йоду
- •33.Характеристтика Хлору за місцем його й періодичній системі
- •34.Фізичні властивості Брому.
- •35.Характеристика Іоду за місцем його у періодичній системі
- •36.Фізичні властивості Хлору
- •37.Хімічні властивості Карбону
- •38.Застосування карбон оксидів
- •39.Хімічні властивості Силіцію
- •40.Кругообіг Карбону у природі
- •41.Хімічні властивості карбонатної кислоти
- •42.Твердість води та способи її усунення
- •43.Хімічні властивості силікатної кислоти
- •45. Характеристика Натрію
- •46.Фізичні властивості лужних металів
- •47.Характеристика Калію
- •48.Хімічні властивості Літію і Натрію
- •49.Характеристика Кальцію
- •50.Хімічні властивості Li Na k
- •60.Сполуки Кальцію
1Порівняльна характеристика Оксигену та Сульфуру..Оксиген і Сульфур —елементи VI групи періодичної системи, належать до головної підгрупи. На відміну від Оксигену, який міститься у другому періоді періодичної системи і електрони в його атомах розміщені на двох електронних шарах (а електрони другого шару—на s- і p-орбіталях), Сульфур міститься у третьому періоді. Це означає, що електрони в атомах Сульфуру розміщені на трьох електронних шарах, а електрони третього шару можуть розміщуватись на s-, р- і d-орбіталях (якщо атом перебуває у збудженому стані). Атом Сульфуру виявляє меншу електронегативність.
2.Хімічні
властивості сульфатної кислоти1)
Взаємодія із металами Zn
+ H2SO4 ![]() ZnSO4
+ Н2
ZnSO4
+ Н2 ![]()
2)
З основними та амфотерними гідроксидами:CuO
+ H2SO4 ![]() CuSO4
+ H2O;
CuSO4
+ H2O;
3) З
основами та лугами:2NaOH + H2SO4
Na2SO4
+ 2Н2О;Cu(OH)2+
H2SO4
CuSO4+
2H2O;4)Із солями:Na2СО3 + H2SO4
Na2SO4
+ CO2![]() +
Н2О;
+
Н2О;
3. Хімічні властивості Оксигену1) Взаємодія із залізом: 4Fe+3O2=2Fe2O3
2) Взаємодія з вуглецем: C+O2=CO2
3)Взаємодія з сіркою: S+O2=SO2
4)Взаємодія з фосфором:4P+5O2=2P2O5
5)Взаємодія зі складними речовинами:
2H2S+3O2=2H2+2SO2
4NH3+3O2=2N+6H2O
4.Застосування сульфуру
Найбільша маса сірки витрачається на виробництво сульфатної кислоти. Сірка використовується і в інших галузях хімічної промисловості, для легкої промисловості, для шкіряного виробництва, виготовлення люмінофорів. Сірку використовують у виробництві барвників, гуми, чорного пороху,сірників, боротьби зі шкідниками у сільському господарстві
5. Хімічні властивості Сульфуру1) Взаємодія з металами
2Cu+S=Cu2S
2) Взаємодія з неметалами
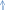 S+O2=SO2
S+O2=SO2
H2+S= H2S
6. Застосування Оксигену Кисень необхідний для випалювання сульфідних руд, забезпечення забезпечення функціонування всіх паливних печей, інтенсифікації хім. та металургійних процесів, дихання живих істот, добування азотної та сірчаної кислот, у медицині( кисневі палатки, пінки), для роботи в екстремальних умовах(у космосі, під водою, землею)
7.Фіичні властивості та застосування сульфатної кислотиСульфатна кислота ( H2SO4) – важка безбарвна оліїста рідина. Нелетка, без запаху. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти. Сульфатна кислота – їдка речовина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг.
Застосування: сульфатна кислота є важливим продуктом хімічної промисловості. Вона у великих кількостях застосовується у виробництві мінеральних добрив, волокон, пластмас, барвників, вибухових речовин, у металургії в процесі добування міді, нікелю, урану та інших металів. Використовується також як осушувач газів.
8 Хімічні властивості Фосфору. Фосфор виявляє як окисні так і відновні властивості
1) взаємодія з металами під час нагрівання, утворюючи фосфіди
3Mg+2P=Mg2P2
2) Взаємодія з неметалами
Фосфор активно взаємодіє з киснем:
4P+3O2=2P2O5, Якщо його підпалити, він згоряє в кисні сліпучим яскравим полум’ям, утворюючи оксид фосфору(V)
З воднем фосфор практично не взаємодіє
11.Хімічні властивості Нітрогену Оскільки Нітроген може виявляти як позитивний, так і негативний ступені окиснення, його проста речовини в реакціях може бути як окисником , так і відновником. 1)Взаємодія з металами:3Mg+N2=Mg3N2
2)Взаємодія з неметалами:
N2+3H2↔2NH3(за наявності каталізатора і високої температури)
Взагалі, хімічний азот як правило вступає в хім. взаємодію за високих температур.
9. Порівняльна характеристика Нітрогену і Фофору Нітроген і Фосфор – типові елементи v групи періодичної системи, належать до головної підгрупи. Ступінь окиснення Нітрогену в сполуках може бути від -3 до +5.
Згідно з кількістю неспарених електронів у основному і збудженому станах атом Фосфору в сполуках може виявляти ступені окиснення -3, +3,+5. Відмінність полягає у тому, що в атомі Фосфору на зовнішньому електронному шарі є вільні d-орбіталі, це дає можливість йому переходити у збуджений стан. Елемент Нітроген у вільному стані існує у формі простої речовини—азоту. Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями. Це — білий, червоний і чорний фосфор. У природі Нітроген зустрічається як у вільному стані, так і у зв'язаному. На відміну від Нітрогену Фосфор зустрічається в природі тільки в сполуках
10.Алотропія фосфору Елемент Нітроген у вільному стані існує у формі простої речовини—азоту. За стандартних умов азот — газ без кольору і запаху. . Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями. Це — білий, червоний і чорний фосфор. Білий фосфор—м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але зазвичай жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка. Червоний фосфор — порошок від темно-коричневого до червоного і фіолетового кольору, , не отруйний, на повітрі окиснюється повільно, у темряві не світиться, гігроскопічний..Чорний фосфор — речовина, схожа на графіт, має шарувату будову, металічний блиск, виявляє властивості напівпровідника, не отруйний. Це найстійкіша алотропна форма. Утворюється з білого фосфору при тривалому нагріванні (200 "С) під великим тиском
11.Хімічні властивості Нітрогену Оскільки Нітроген може виявляти як позитивний, так і негативний ступені окиснення, його проста речовини в реакціях може бути як окисником , так і відновником. 1)Взаємодія з металами:3Mg+N2=Mg3N2
