
- •Предисловие
- •Роль и место задач в школьном курсе химии
- •Методика обучения учащихся решению задач по химии
- •Задачи для самостоятельного решения
- •Содержание
- •Использование дидактических возможностей компьютера в обучении учащихся решению задач по химии
- •Использование модульных обучающих программ при составлении опорных конспектов
- •Решение задач по химии (2005) 8 –9 классы
- •Решение задач по химии (2005), 8-9 класс
- •Вот новые задачи
- •Задача № 12
- •Методика задачи №6
- •Задача № 12. Задача на галогены
- •Задача № 13 Задача на электролиз
- •Задача № 15
- •Контрольные задачи
Методика обучения учащихся решению задач по химии
Методика обучения определяется как педагогическая наука, исследующая закономерности обучения определенному учебному предмету. (Зайцев О.С.), соответственно, методика обучения решению задач по химии может представлять частную методику, исследующую закономерности обучения решению задач. Как в любой деятельности исследование посвящается разрешению известных (конкретных) проблем. Например, в нашем случае это: Каковы самые типичные ошибки школьника при решении задач? Почему допускают школьники такие ошибки? Как преодолеть все эти трудности? Как учителю предвидеть эти трудности? Как повысить эффективность обучения решению задач? Возможна ли рационализация решения задач по химии (типа: «все гениальное очень просто»)? Могут ли быть универсальные подходы к решению задач? Можно ли овладеть всеми известными методами решения задач и сказать что: «Я владею методикой обучения решению задач по химии»?
Вам предлагаются несколько методических приемов (ситуаций) обучения решению задач. Оцените их с методической точки зрения.
Методисты считают, что даже правильное, компактное оформление задачи представляет собой особый прием обучения решению задач. Например, Штремплер Г.И. и Хохлова А.И. считают, что «решение задачи следует начинать с анализа условия и составления плана её решения» и «каждое действие решения оформляется вопросом». Для примера разберем решение одной типовой задачи:
Определите массу соли, образующейся при взаимодействии растворов, содержащих 12 г серной кислоты и 22 г гидроксида кальция.
Действия учителя |
Действия учащихся |
Указывает номер задачи и читает условие задачи, выделяя голосом опорные слова: «массу соли», «12 г серной кислоты», «22 г гидроксида кальция». |
Находят задачу и вместе с учителем знакомятся с условием задачи. |
Что требуется найти по условию задачи? Какой соли? Известно ли какая соль образуется, если между собой взаимодействуют серная кислота и гидроксид кальция? Как узнать? Пишем уравнение реакции. Обязательно ли, надо написать уравнение реакции? |
Массу соли. Надо написать уравнение реакции. Пишут уравнение реакции: H2SO4 + Ca(OH)2 = CaSO4 + 2H2O Это сульфат кальция. Да, так как, мы не сможем точно сказать в каком соотношении исходные вещества взаимодействуют между собой и образуются продукты реакции. |
Т.е., надо найти массу ...? |
Будем находить массу сульфата кальция. |
Дано: m(H2SO4) = 12 г m(Ca(OH)2 = 22 г m(CaSO4) = ? |
Записывают в тетради краткую запись: Дано: m(H2SO4) = 12 г m(Ca(OH)2 = 22 г m(CaSO4) = ? |
Теперь, согласно условию задачи, нам даны массы серной кислоты – 12 г, где это пишем? Да, это пишем над формулой серной кислоты; а 22 г гидроксида кальция?, Это пишем над формулой гидроксида кальция. Неизвестна нам масса соли и как обозначим это? Да, через х г. Чем эта задача отличается от тех задач, которые мы решали? В этой задаче даны массы не только одной кислоты, но и….? |
Дана масса не только кислоты, но и щелочи. Пишут данные из условия задачи над формулами веществ 12 г 22 г х г H2SO4 + Ca(OH)2 = CaSO4 + 2H2O В этой задаче дана не только масса кислоты, но и масса щелочи. |
Согласно уравнению реакции в реакцию вступает 1 моль кислоты, 1 моль щелочи и образуется 1 моль соли; записываем все это под формулами веществ. А теперь, определим молярные массы и массы этих веществ количеством в 1 моль, так как по условию задачи надо найти массу соли. |
Находят молярные массы и массы веществ количеством вещества по уравнению реакции 12 г 22 г х г H2SO4 + Ca(OH)2 = CaSO4 + 2H2O ν 1 моль 1 моль 1 моль М 98 г/моль 74 г/моль 136 г/моль M 98 г 74 г 136 г |
Раз нам даны массы обоих исходных веществ, то от чего будет зависеть масса конечного продукта (соли)? От массы какого вещества, которого дано в избытке или от массы вещества, данного в недостатке (мало)? Да, конечно, все будет зависеть от массы вещества, данного в недостатке. А почему, можете объяснить? Да, в действительности, реакция сразу прекратится, как только вещество, которое дано в недостатке полностью вступит (израсходуется) в реакцию. Какое же вещество дано в избытке, а какое в недостатке? Давайте определим по известной нам формуле: ν1= m/M. Какое из исходных веществ останется после реакции? Подпишите под соответствующими формулами веществ «в недостатке» и «в избытке» для удобства. |
Реакция сразу прекратится, как только вещество, которое дано в недостатке полностью вступит (израсходуется) в реакцию. Определяют, какое количество вещества серной кислоты и гидроксида кальция были взяты для реакции 12 г 22 г х г H2SO4 + Ca(OH)2 = CaSO4 + 2H2O ν 1 моль 1 моль 1 моль М 98 г/моль 74 г/моль 136 г/моль m 98 г 74 г 136 г ν1= m/M= 0,12моль; 0,3 моль в недост. в избыт. |
Тогда масса соли будет зависеть только от массы …? Значит, для расчета массы соли необходимо учитывать только массу …? |
Серная кислота дана в недостатке, мало её, а щелочь дана в избытке; значит, после реакции останется еще много щелочи. Масса соли будет зависеть только от массы серной кислоты, так как, как только её не станет, реакция прекратится. |
Значит, для расчета будем пользоваться данными только серной кислоты, составим пропорцию и решим задачу как обычно. |
Составляют пропорцию и решают: 12 г H2SO4 х г CaSO4 98 г H2SO4 136 г CaSO4 х = 16,6 г Ответ: получится 16,6 г CaSO4 |
|
Надо сначала определить какое вещество полностью вступает, а какое не полностью. |
Т.е., определить что дано в избытке, что в недостатке (по формуле), а потом расчет вести только по недостатку. Запишите это в тетради как правило. Можете обвести это правило аккуратно цветом, чтобы потом, когда надо, быстро найти. |
Пишут вывод: Если в задаче даны массы исходных веществ (обоих), то сначала надо определить, какое вещество дано в избытке, а какое в недостатке, потом расчет вести по недостатку, т.к. масса конечного продукта будет зависеть от массы того вещества, которое дано в недостатке. |
Что к методике обучения решению задачи данного типа относится:
беседа, которую ведет учитель по ходу решения задачи;
оформление задачи на доске (дано, все этапы, выводы и др.);
требования к оформлению задачи в ученических тетрадях?
все выше перечисленное?
Выявлено, что в большей степени школьники затрудняются в анализе условия задачи. Большинство из них не вникают в суть задачи, т.е. не воспринимают задачу как проблему, им кажется, что достаточно найти формулу (при том готовую) или решение аналогичной задачи, то совсем все просто решить задачу, т.е. большинство нацелено на «готовое решение». Некоторые, в силу отсутствия практики (никогда про это не слышали, такие опыты не делали, в руках не держали, никогда в жизни с этим не сталкивались) не могут все описанное в задаче образно («зрительно») себе представить. Соответственно, ученик даже при большем желании решить, научиться решать подобные задачи, ничего не сможет сделать. В этом случае помогает особое оформление задачи, где план решения можно схематично представить. Это может быть схема, рисунок. Рассмотрим, несколько примеров, как можно создать «образ химической задачи», при этом используются соответствующие методы решения расчетных задач, как метод пропорций, алгебраический и др.
Русским химиком Ловицем впервые был получен в 1796 г КОН . nH2O. Какова формула этого гидрата, если известно, что он содержит 39,1% воды?
Предлагается методика обучения школьников решению подобных задач. Учитель читает (или ученик, умеющий анализировать) условие задачи, ставит вопросы: Что мы будем находить? Что такое гидрат? Чему может быть равно n? Что нам известно по условию задачи? С чего начнем решение задачи? и др.
Д ано:
ано:
Общая формула гидрата - КОН . nH2O
ω (nH2O)
= 39,1%
(nH2O)
= 39,1%
Найти n -? и КОН . nH2O - ?
Учитель: 39,1% - это массовая доля кристаллизационной воды, тогда чему равна массовая доля щелочи, если все вместе (щелочь с кристаллизационной водой) составляет … ? Давайте это схематично зарисуем (запишем).
Представленный “образ” задачи
 Целое
- 100%
Целое
- 100%
? (100-39,1) 39,1%
КОН . n
H2O
Мr (КОН . nH2O) = 56 + 18n
На основе “образа” задачи составим пропорцию:
 56
+ 18n
г 100%
56
+ 18n
г 100%
 18n
г 39,1%
18n
г 39,1%
Возможно и другое рассуждение:
 56
г 60,9%
56
г 60,9%
18n г 39,1%
Решив уравнение, учащиеся находят, что n = 2.
Ответ: Формула гидрата - КОН . 2H2O.
Как вы думаете, действительно, такое оформление решения, раскрывающее связи между составляющими (компонентами) условия задачи, будет способствовать пониманию сущности задачи (что к чему относится, что надо найти и т.д.)?
Рассмотрим другой пример.
Имеется 330 г насыщенного раствора при 400 С раствора нитрата калия. Сколько граммов соли выкристаллизуется при охлаждении раствора до 300 С? ( растворимость КNO3 при 300 С = 45, при 400 С = 63)
Учитель: Что надо найти?
Учащиеся: Массу кристаллов, выпавших после охлаждения.
Учитель: для наглядности давайте схематично нарисуем то, что происходит при охлаждении раствора (рисует на доске, сопровождая комментариями). Обозначим за х г массу выпавших кристаллов. При этом масса раствора изменится или нет? Станет больше или меньше? На сколько станет меньше?
В этом случае можно воссоздать такой «образ» задачи

 400С
300С
400С
300С
Масса раствора = (330-х) г



 330 г
охлаждение Масса раств.
в-ва = (у-х) г
330 г
охлаждение Масса раств.
в-ва = (у-х) г
 х г
кристаллов
х г
кристаллов
 Масса раствора –
330 г Масса раствора - ?
Масса раствора –
330 г Масса раствора - ?
Растворимость – 63 г на 100г воды; Растворимость - 45 г на 100 г воды.
Учащиеся: масса раствора станет на х г меньше.
Учитель: А масса растворенного вещества? Если обозначим массу растворенного вещества в первоначальном растворе за у г, после охлаждения определенная часть (это х г) выпадает в виде кристаллов, тогда чему будет равна масса раствора при 300С ?
Учащиеся: масса растворенного вещества станет равной (у –х) г.
Учитель:
Для наглядности все это запишем рядом
со вторым стаканом. Теперь можно начинать
решение задачи. М
 ожем
ли найти массу растворенного вещества
в первоначальном растворе? В (100 + 63) 163 г
раствора растворено 63 г соли растворено,
в 330 г раствора – у г соли; у = 127,54 г. А
теперь, после охлаждения в (100 + 45) 145 г
раствора – 45 г соли, в (330 - х) г раствора
– (127,54 - х ) г соли; решив уравнение
получаем х = 36,43 г. Ответ: масса выпавших
кристаллов равна 36,43 г.
ожем
ли найти массу растворенного вещества
в первоначальном растворе? В (100 + 63) 163 г
раствора растворено 63 г соли растворено,
в 330 г раствора – у г соли; у = 127,54 г. А
теперь, после охлаждения в (100 + 45) 145 г
раствора – 45 г соли, в (330 - х) г раствора
– (127,54 - х ) г соли; решив уравнение
получаем х = 36,43 г. Ответ: масса выпавших
кристаллов равна 36,43 г.
Задачу можно решить более рациональным способом, составив единственную пропорцию:
163 г раствора при 400С ------------- 145 г раствора при 300С
330 г раствора --------------- у г раствора; у = 293, 5 г
За счет чего масса раствора стало меньше? Разница в массе растворов и есть масса выпавших кристаллов 330 – 293,5 = 36,5 г.
Вопросы и задание: Какой способ, на ваш взгляд, более полно раскрывает логические связи в задаче? Будете ли строго требовать решение конкретным способом? В каком классе можно предложить школьникам такую задачу? Какую или какие функции несет данная задача? Составьте и разработайте методику обучения решению задачи на усвоение понятий «насыщенный раствор», растворимость веществ.
Рассмотрим методику обучения решению задач на растворы.
Какую массу 5% -ного раствора щелочи надо добавить к 200 г 40%- ного раствора, чтобы получить 25% -ный раствор?
 ω1
= 5% ω2
= 40% ω3
= 25%
ω1
= 5% ω2
= 40% ω3
= 25%
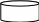

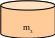

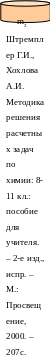
+ =
m1 = ? m2 = 200 г m3 = m1 + m2
m1 = х г m2 = 200 г m3 = х + 200
Масса р. в-ва m1 = m1 . ω1 + m2 = m2 . ω2 = m3 = m3 . ω3
m1 = х . 0,5 + m2 = 200. 0,4 =80 = m3 = (х +200) . 0,25
х . 0,5 + 80 = (х +200) . 0,25; х = 150 г.
Ответ: надо добавить 150 г 5%-ного раствора щелочи.
Вопросы и задание: Соответствующий ли «образ» задачи представлен? Наглядна ли логика рассуждения при таком оформлении задачи? Достаточно ли компактно оформление? Какое дополнение или изменение вы бы могли внести в методику обучения решению подобных задач? В чем могло быть затруднение учащихся? Составьте письменно устное сопровождение методики обучения решению аналогичной задачи и представьте соответствующий «образ».
Известна типовая задача на выведение формулы вещества, часто подобные задачи решают в 10 классе на выведение формул органических веществ. Хотя учащиеся решают сравнительно часто задачи этого типа в течение всего курса органической химии, тем не менее, не все успешно справляются с заданием. Причина, видимо, в отсутствии полного анализа, неумении устанавливать логические связи. В методике известны несколько способов решения задач данного типа.
Найдите молекулярную формулу газообразного углеводорода, если при сжигании 10, 5 г его было получено 16,8 л (н.у.) оксида углерода (IV) и 13,5 г воды. Плотность его паров по водороду равна 21.
Первый способ решения известен как применение метода поэтапного решения, когда задача разбивается на четкие этапы и учащиеся решают задачу как решение нескольких проблем. Назовем эти проблемы: 1) Полностью ли углерод (как элемент) углеводорода переходит в состав углекислого газа или нет? 2) Полностью ли водород (как элемент) углеводорода переходит в состав воды или нет? Правомерно ли считать, что нашли массу углерода в углеводороде, найдя массу углерода в СО2? Найдя, массу водорода в Н2О, что нашли массу водорода в углеводороде? 3) Можно ли путем сжигания веществ определять их формулы (качественный и количественный состав)? Известны ли вам подобные эксперименты, исследования?
Как практика показывает, несмотря, на довольно несложное содержание самой задачи, учащиеся не всегда улавливают, о чем речь идет, даже то, что вещество сгорает и получаются продукты реакции горения. Даже выполнение практической работы «Обнаружение углерода и водорода в органическом соединении» путем исследования продуктов горения, не помогает пониманию «истины» данного типа задачи. Следуя рекомендациям исследователей проблемы обучения решению задач (Д. Пойа, И.И. Геращенко, Е.Н. Кабанова-Меллер, Г.И. Штремплер и др.) в первую очередь, необходимо понимание постановки задачи (что надо найти и что нам для этого дано), во-вторых, найти верный путь решения задачи.
При решении задачи на выведение формулы вещества можно, воссоздать «образ» задачи таким образом.


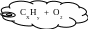 х
СО2
у/2
Н2О
х
СО2
у/2
Н2О
При сжигании углеводорода
Решение: 1 этап – нахождение молярной массы углеводорода. 2 этап - нахождение массы углерода и массы водорода. 3 этап – нахождение отношение числа атомов углерода и водорода; нахождение простейшей формулы. 4 этап – проверка правильности решения, нахождение истинной формулы вещества.
Сначала схематично пишем уравнение реакции горения углеводорода:
СхНу + О2 СО2 + Н2О
1 этап. Молярная масса углеводорода: М = 2 . DH2 = 2 . 21 = 42 г/моль.
2 этап. а) m (С) = ? В 22,4 л СО2 ---- 12 г С
В 16,8 л СО2 ---- х г С ; х = 9 г.
б) m ( Н) = ? В 18 г Н2О ----- 2 г Н
В 13,5 г Н2О ----- у г Н; у = 1,5 г.
m(CxHy) = 9 + 1,5 = 10,5 г.
3 этап. С : Н = 9/12 : 1,5/1 = 0,75 : 1,5 = 1 : 2.
СН2 - простейшая формула.
4 этап. Мr (СН2)n = 42
(12 + 2 ) . n = 42
14 n = 42
n = 3.
Ответ: C3Н6 – пропен или циклопропан.
Второй способ основан на применение алгебраического метода.
10,5 г 16,8 л 13,5 г
СхНу + О2 х СО2 + у/2 Н2О
1 моль х моль у/2 моль
(42 г /моль 22,4 л /моль 18 г/моль)
= 10,5/42 = 0,25 моль; = 16,8/22,4 = 0,75 моль; = 13,5/18 = 0,75 моль.
Решим пропорции: а) 1 моль/ 0,25 моль : х моль/ 0,75 моль; х = 3 моль атомов С. б) 1 моль/ 0,25 моль : у моль / 0,75 . 2; у = 6 моль атомов Н.
Ответ: С3Н6.
Вопросы и задание: Какой метод решения более доступен для учащихся? Зависит ли это от профиля обучения? Какова логика рассуждения при составлении пропорции? Достаточно ли хорошо помогает созданию “образа задачи” представленное оформление задачи? Составьте письменно беседу учителя при анализе задачи по одному из методов решения.
Определенную трудность представляют задачи на смеси веществ. Очень часто, школьникам мешает нечеткое понимание, что такое смесь веществ. В первую очередь школьники должны усвоить, что в смесях свойства веществ сохраняются, следовательно, каждое индивидуальное вещество самостоятельно вступает в химическую реакцию. Поэтому для каждого компонента смеси необходимо написать отдельно уравнение реакции (очень часто школьники умудряются для смеси веществ написать одно уравнение реакции, будто смесь – индивидуальное вещество). Рассмотрим методику обучения решению задачи на смеси веществ.
При сжигании 2 г смеси серы и угля образовалось 6 г смеси сернистого газа и углекислого газа. Сколько граммов серы и угля было в первоначальной навеске?
Д ано:
Анализ: S
и С – простые вещества, горючие,
ано:
Анализ: S
и С – простые вещества, горючие,
m (смеси S и С) = 2 г при горении 1 моль С образуется 1 моль СО2;
 m
(смеси SO2
и СО2)
= 6 г при горении 1 моль С образуется
1 моль СО2;
m
(смеси SO2
и СО2)
= 6 г при горении 1 моль С образуется
1 моль СО2;
m (S) - ?
m (С) - ?
Задачу можно решить несколькими способами: составлением уравнения с одним неизвестным или системы уравнений с двумя неизвестными. Сначала пишем уравнения реакций:
x г m г (2 –x) г n г
C + O2 = CO2 ; m = 44x/12; S + O2 = SO2; n = 64(2-x)/32;
12 г 44 г 32 г 64 г
m + n = 6;
44x/12 + 2(2-x) =6; Составив уравнение, получаем: x = 1,2;
Ответ: m (C ) = 1,2 г; m (S ) = 0,8 г.
Эту задачу можно решить другим способом:
х г m г y г n г
C + O2 = CO2; m = 44x/12; S + O2 = SO2; n = 64y/32;
12 г 44 г 32 г 64 г
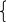 x
+ y = 2;
x
+ y = 2;
m + n = 6. Составив систему уравнений получаем: 44x/12 + 2y = 6; x = 2 – y; 3,666( 2 – y ) + 2y = 6; y = 0,8; x = 1,2; Ответ: m (C ) = 1,2 г; m (S ) = 0,8 г;
Вопросы и задание: Учащимся, какого класса можно предложить эту задачу? С какой целью? Какую функцию (обучающую, развивающую, воспитательную) в большей степени несет задача? Какова, на ваш взгляд, химическая составляющая (в отличие от математической составляющей) задачи? Почему не все школьники решают подобную задачу? Какой из способов более рациональный? Можете ли предложить другой способ решения задачи? Составьте задачу на смесь, где компонентами являются металлы с различной химической характеристикой (например, алюминий и железо, или медь и цинк и др.). Разработайте методику обучения решению подобных задач (беседу, которую учитель ведет во время решения задачи, проблему, которая поднимается, общий вывод, который надо сформулировать).
Через емкость с бромной водой пропущена смесь метана с этиленом объемом 5 л. При этом масса склянки увеличилась на 5,6 г. Рассчитайте объемные доли компонентов исходной смеси в %.
П ри
анализе создается примерно такой «образ»
задачи:
ри
анализе создается примерно такой «образ»
задачи:

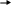 5 л
5 л









 Масса
склянки с Br2
. aq
Масса
склянки с Br2
. aq
= m г m (склянки) + 5,6 г
Раствор обесцветился
Схематичный рисунок показывает, что масса склянки увеличилась на 5,6 г.
Беседа учителя: За счет чего произошло увеличение массы склянки? С каким из газов может взаимодействовать бромная вода? Значит, увеличение на 5,6 г произошло в результате взаимодействия этилена, который взаимодействует с бромной водой, тогда получается, что этилена было 5,6 г, путем составления пропорции находим какому объему это соответствует: 22,4 л /28 : х/5,6; х = 4,48 л.
Ответ: V(СН4) = 5-4,48 = 0,52 л, V(С2Н4) = 4,48 л.
Задание: Оцените методическую ценность «образа» задачи. Составьте одну подобную задачу на смеси органических веществ (углеводородов, спиртов, альдегидов, кислот, углеводов и др.) и предложите «образ» задачи с методическим сопровождением.
Железная пластинка массой 10 г опущена на некоторое время в 160 мл 15% - ный раствор сульфата меди (II) плотностью 1,12. После того как пластинку вынули, промыли и высушили, ее масса оказалась равной 10,8 г. Какова массовая доля сульфата меди в оставшемся растворе?
Методика: 1) Оформление задачи (что дано, что надо найти), 2) Беседа учителя: Какой тип реакции? Железо вытесняет медь из раствора ее соли, так как …? Почему масса железной пластинки увеличилась? За счет чего? Согласно уравнению реакции 1 моль железа вытесняет 1 моль меди, при этом масса пластинки увеличивается на … г? 3) По ходу беседы создается следующий «образ» задачи:
Остается
 CuSO4
CuSO4
 10 г Fe
10 г Fe




 после
реакции 10,8 г
после
реакции 10,8 г
 р-р CuSO4
m
?
р-р CuSO4
m
?
Fe + CuSO4 = FeSO4 + Cu.
1моль 1моль 1моль 1моль
 56 г
160 г 152 г 64 г
56 г
160 г 152 г 64 г
∆ m = 64-56 = 8 г
Решение: Масса исходного раствора: m = 160 .1,12 = 179,2 г (p = m:v). Масса безводного сульфата меди = 179,2 . 0,15 = 26,88 г. Когда масса пластинки увеличивается на 8 г согласно стехиометрическому уравнению, в реакцию вступает 160 г сульфата меди, по условию задачи масса пластинки увеличивается на (10,8 - 10) = 0,8 г, тогда масса вступившего в реакцию сульфата меди: m = (160 . 0,8) : 8 = 16 г. После реакции в растворе осталось: 26,88 – 16 = 10,88 г соли. Масса раствора после реакции 179,2 - 0,8 = 178,4 г, тогда w ( CuSO4 ) = (10,88 . 100 ) : 178,4 = 6,098%.
Задание: В каком классе, при изучении какой темы можно предложить школьникам такую задачу? Хотя задача не относится к трудным, тем менее не все школьники понимают сущность задачи, особенно что «масса пластинки увеличивается на сколько-то г». Что еще можно придумать (в методическом плане), чтобы учащиеся ясно себе представляли «химическую картину» задачи? Составьте одну подобную задачу и предложите ее методическое решение.
Ведущая роль в обучении учащихся решению задач принадлежит учителю. Выбирая задачу для учащихся, учитель обязан оценивать ее с точки зрения следующих целей:
Какие понятия, законы, теории, факты должны быть закреплены в процессе решения, какие стороны свойств изучаемого вещества и химической реакции отмечены в процессе решения задачи.
Какие приемы решения задачи должны быть сформированы.
Какие мыслительные приемы развиваются в процессе решения задачи.
Какие дидактические функции выполняет данная задача.
Задание: Составьте 5 задач на закрепление: 1) одного из химических понятий, 2) одного из законов, 3) одной из теорий, 4) свойств двух различных веществ (металла, неметалла, кислоты, основания, органического соединения и др.). Оцените каждую задачу с точки зрения выделенных целей.
Приобретению профессиональных знаний и методических умений, несомненно, окажет хорошо подобранная литература. В настоящее время имеется достаточно много учебной литературы для школьников и абитуриентов, где рассматриваются решения почти всех типов задач. Сравнительно мало методической литературы, где бы рассматривались различные подходы к обучению решению расчетных задач, проблемы использования задач как средство углубления знаний учащихся или развития мыслительных операций.
Задание: Ознакомьтесь с предложенной учебной и методической литературой для учащихся и учителя. Напишите рецензию на одно учебное и одно методическое пособие. В рецензии необходимо указать востребованность рецензируемого пособия, соответствие современным требованиям (программным, ЕГЭ и др.), полно ли охватывается разнообразие типов задач, сравните между собой пособия, найдите различие. Оцените дидактические возможности каждого пособия.
Учебная литература для школьников:
1. Гольдфарб Я.Л. и др. Сборник задач и упражнений по химии: Учеб. пособие для учащихся 8-9 (8-11) кл. сред. шк. - М.: Просвещение, 1987 (или последних лет).
2. Гудкова А.С и др. 500 задач по химии: Пособие для учащихся. – М.: Просвещение, 1981. – 159с.
3. Кузьменко Н.Е. и др. Задачи по химии для абитуриентов: Курс повышенной сложности с компьютерным прил. –М.: Просвещение, 1992. –191с. (или издание поздних лет)
4. Кульман А.Г. Сборник задач по общей химии. Учебное пособие. –М. «Высш. школа», 1975. – 205с.
5. Кушнарев А.А. Задачи по химии для старшеклассников и абитуриентов. – М.: Школа-Пресс, 1999. – 160 с.
6. Магдесиева Н.Н., Кузьменко Н.Е. Учись решать задачи по химии. – М.: Просвещение, 1986.
7. Свитанько И.В., Харон Ю.Я. ЭВМ в решении расчетных химических задач: Учебное пособие для средней школы. – М.: МИРОС, 1994. – 128с.
8. Середа И.П. Конкурсные задачи по химии. Поступающим в вузы. –Киев: Вища школа. 1982. – 232с.
9. Слета Л.А. и др. Конкурсные задачи по химии с решениями (для старшеклассников и абитуриентов). – Москва-Харьков. – 1998. – 96с.
Химические олимпиады в школе / Сост. С.Н. Перчаткин, М.Ф. Дорофеев. – М.: НПО «Образование», 1997. – 104с.
11. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы: Учебное пособие. – М.: Высш.школа, 1991 (или других годов). – 253с.
12. Шамова М.О. Учимся решать расчетные задачи по химии: технология и алгоритмы решения – М.: Школа-Пресс, 2001. – 96 с.
Учебно-методическая литература для учителя:
1. Андреева М.П. Олимпиадные задачи по химии. – Якутск: ИПКРО, 1999 . – 80с.
2. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии: Учебное пособие для студентов пед. ин-тов по биол. и хим. спец. – М.: Просвещение, 1989. – 176с.
3. Лабий Ю.М. Решение задач по химии с помощью уравнений и неравенств: Кн. для учителя. – М.: Просвещение, 1987. – 80с.
4. Николаенко В.К. Сборник задач по химии повышенной трудности: учебное пособие для средних учебных заведений. –М.: РОСТ, МИРОС, 1996. – 192с.
5. Сборник олимпиадных задач по химии с решениями: Пособие для учителя /Сост. Андреева М.П., Егорова К.Е. – Якутск, Кудук, 2001. – 80с.
6. Цитович И.К., Протасов П.Н. Методика решения расчетных задач по химии. Пособие для учителя. – М.: Просвещение, 1983. – 108с.
7. Штремплер Г.И., Хохлова А.И. Методика решения расчетных задач по химии: 8-11 кл.: пособие для учителя. – 2-е изд., испр. – М.: Просвещение, 2000. – 207с.
Итак, подведем итог. Решение задач:
учит мыслить, ориентироваться в проблемной ситуации;
предполагает активную продуктивную деятельность с определенной глубиной, широтой и самостоятельностью решения, которая должна быть направлена на перенос знаний на новые объекты;
проявляет взаимосвязь представлений и понятий;
содействует конкретизации и упрочнению знаний;
ведет к лучшему пониманию учащимися химических явлений в свете важнейших теорий;
позволяет установить связь химии с другими предметами, особенно с физикой и математикой;
является средством закрепления в памяти учащихся химических законов и важнейших понятий;
служит одним из способов учета знаний и проверки навыков, полученных в процессе изучения предмета;
воспитывает у учащихся умение использовать полученные знания для решения практических проблем, тем самым, связывая обучение химии с жизнью и деятельностью человека.
Таким образом, в обучении химии решение задач преследует несколько целей: закрепление изученного учебного материала, расширение прикладных, углубление теоретических знаний учащихся, также развитие мыслительных операций, как анализ, сопоставление, абстрагирование, и логики рассуждения.
Вам предлагаются задачи для самостоятельного решения. Оцените методическую ценность задачи (интересная, оригинальная, подходит для закрепления, можно использовать при изучении новой темы для создания проблемной ситуации, при углублении таких теоретических вопросов, как … , … и др.). Решите все задачи. Из нижепредложенных задач выберите 5 разноплановых задач и разработайте к ним подробную методику обучения учащихся их решению с соблюдением требований (оформление записи, анализ-рассуждение, создание образа и др.).


 Сначала
запишем кратко условие задачи:
Сначала
запишем кратко условие задачи:

 Сделаем
общий вывод. Как такого типа задачи,
когда даются данные двух исходных
веществ, когда неизвестно, какое
вещество полностью вступает, а какое
неполностью в ходе реакции не
расходуется, нужно решать? Что
обязательно надо учитывать?
Сделаем
общий вывод. Как такого типа задачи,
когда даются данные двух исходных
веществ, когда неизвестно, какое
вещество полностью вступает, а какое
неполностью в ходе реакции не
расходуется, нужно решать? Что
обязательно надо учитывать?