
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называютсящелочами.
Согласно протонной теории кислот и оснований, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
Получение
Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
![]()
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
![]()
Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
![]()
Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
![]()
Некоторые основания можно получить реакциями обмена:
![]()
Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Классификация
Основания классифицируются по ряду признаков.
По растворимости в воде.
Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2,гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
По количеству гидроксильных групп в молекуле.
Однокислотные (гидроксид натрия NaOH)
Двукислотные (гидроксид меди(II) Cu(OH)2)
Трехкислотные (гидроксид железа(III) Fe(OH)3)
По летучести.
Летучие: NH3, CH3-NH2
Нелетучие: щёлочи, нерастворимые основания.
По стабильности.
Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
По степени электролитической диссоциации.
Сильные (α > 30 %): щёлочи.
Слабые (α < 3 %): нерастворимые основания.
По наличию кислорода.
Кислородсодержащие: гидроксид калия KOH, гидроксид стронция Sr(OH)2
Бескислородные: аммиак NH3, амины.
По типу соединения:
Неорганические основания: содержат одну или несколько групп -OH.
Органические основания: органические соединения, являющиеся акцепторами протонов: амины, амидины и другие соединения.
Номенклатура
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
NaOH — гидроксид натрия
TlOH — гидроксид таллия(I)
Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
TiO(OH)2 — дигидроксид-оксид титана
MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
AlO(OH) — метагидроксид алюминия
CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
Tl2O3•n H2O — полигидрат оксида таллия(III)
MnO2•n H2O — полигидрат оксида марганца(IV)
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
NH3•H2O — гидрат аммиака
N2H4•H2O — гидрат гидразина
Химические свойства
В водных растворах основания диссоциируют, что изменяет ионное равновесие:
![]()
это изменение проявляется в цветах некоторых кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
![]()
Примечание: реакция не идёт, если и кислота и основание слабые.
При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
![]()
![]()
Амфотерные основания могут реагировать с щелочами с образованием гидроксокомплексов:
![]()
Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
![]()
![]()
Основания вступают в обменные реакции (реагируют с растворами солей):
![]()
Слабые и нерастворимые основания при нагреве разлагаются на оксид и воду:
![]()
Некоторые основания (Cu(I), Ag, Au(I)) разлагаются уже при комнатной температуре.
Основания щелочных металлов (кроме лития) при нагревании плавятся, расплавы являются электролитами.
С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. В общем виде уравнение электролитической диссоциации основания имеет вид: Основание -> Катион основания + Гидроксид - ион
NaOH |
Кислотность основания
Число групп ОН в молекуле основания, способных дать ионы гидроксила, определяет кислотность основания.

Щелочи
ЩЕЛОЧИ - хорошо растворимые в воде основания, создающие в водном растворе большую концентрацию ионов ОН-. К щелочам относятся гидроксиды металлов подгрупп Iа и IIа периодической системы ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ - химические элементы Ве, Мg, Ca, Sr, Ba, Ra. Названы так потому, что их оксиды - "земли" (по терминологии алхимиков) - сообщают воде щелочную реакцию.
Основания
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами - ОН.Общая формула:
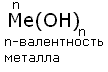
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Формула |
Название |
Формула |
Название |
LiOH |
гидроксид лития |
Ca(OH)2 |
гидроксид кальция |
NaOH |
гидроксид натрия |
Cu(OH)2 |
гидроксид меди(II) |
KOH |
гидроксид калия |
Fe(OH)3 |
гидроксид железа(III) |
Классификация оснований
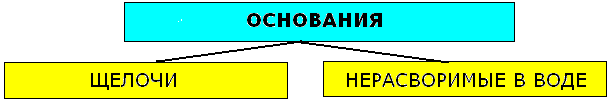
Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные - нерастворимые. К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
См. "Классификация оснований"
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
Способы получения оснований
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra)
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА – щелочного металла (Li, Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ + ЩЁЛОЧЬ = новое ОСНОВАНИЕ + новая СОЛЬ
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Химические свойства ОСНОВАНИЙ: 1. Действие на индикаторы: лакмус - синий, метилоранж - жёлтый, фенолфталеин - малиновый, 2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O 3. Щёлочь + кислотный или амфотерный оксид = соли + вода 2NaOH + SiO2 = Na2SiO3 + H2O 4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH 5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O 6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) = NaNO3+Ag2O+H2O
