
- •Комп'ютерні технології у фармації
- •Виконав
- •Задача №2
- •Теоретична частина
- •Побудова ряду переваг впливу градацій фактора на показник, що вивчається
- •Порядок виконання порівнянь
- •Утворення груп однорідних середніх
- •Розрахункова частина
- •Висновки
- •Задача № 41
- •Теоретична частина
- •Розрахункова частина
- •Висновки
- •Задача № 65
- •Теоретична частина
- •Розрахункова частина
- •Висновки
- •Література
Розрахункова частина
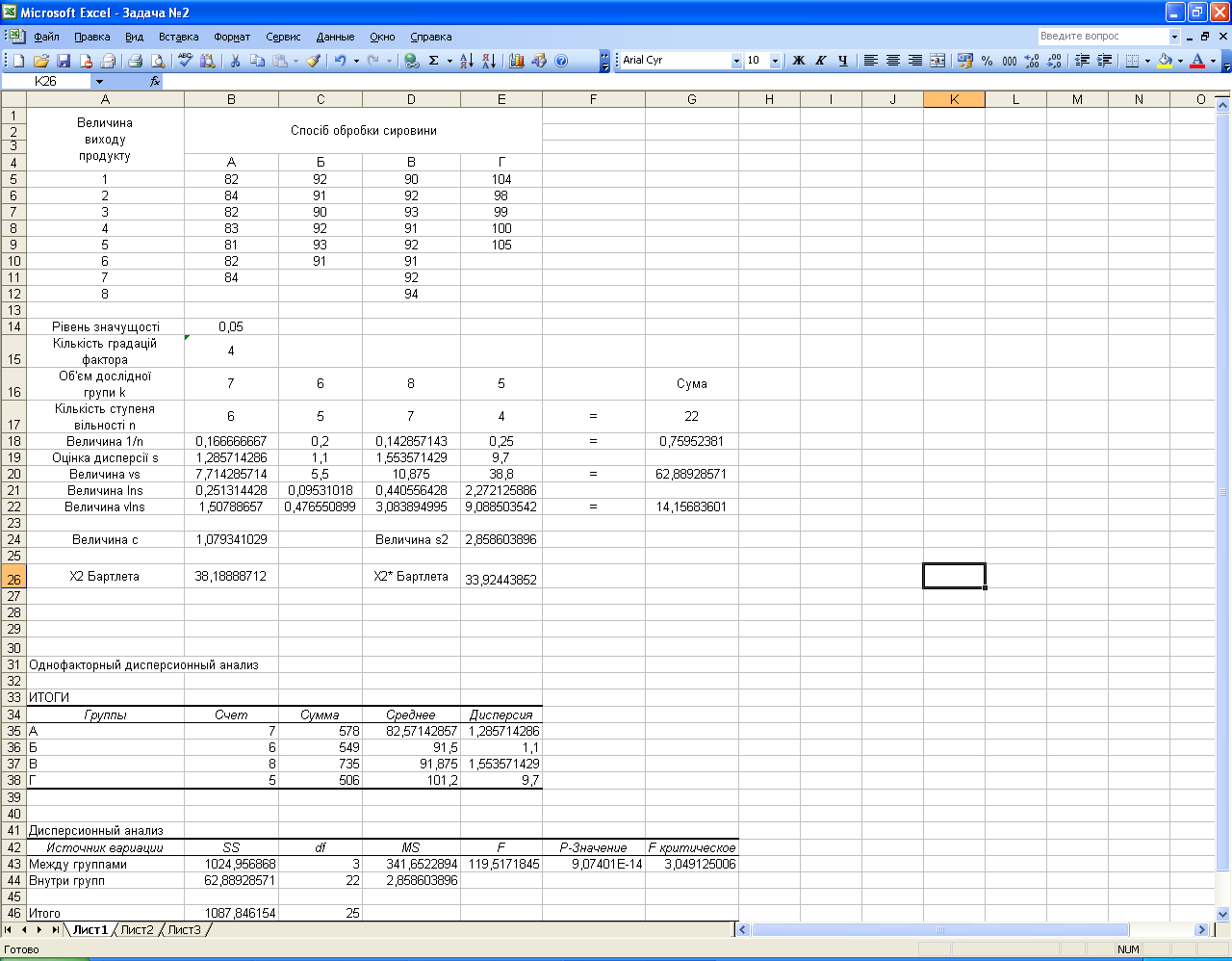
Мал. 1.1

Мал. 1.2
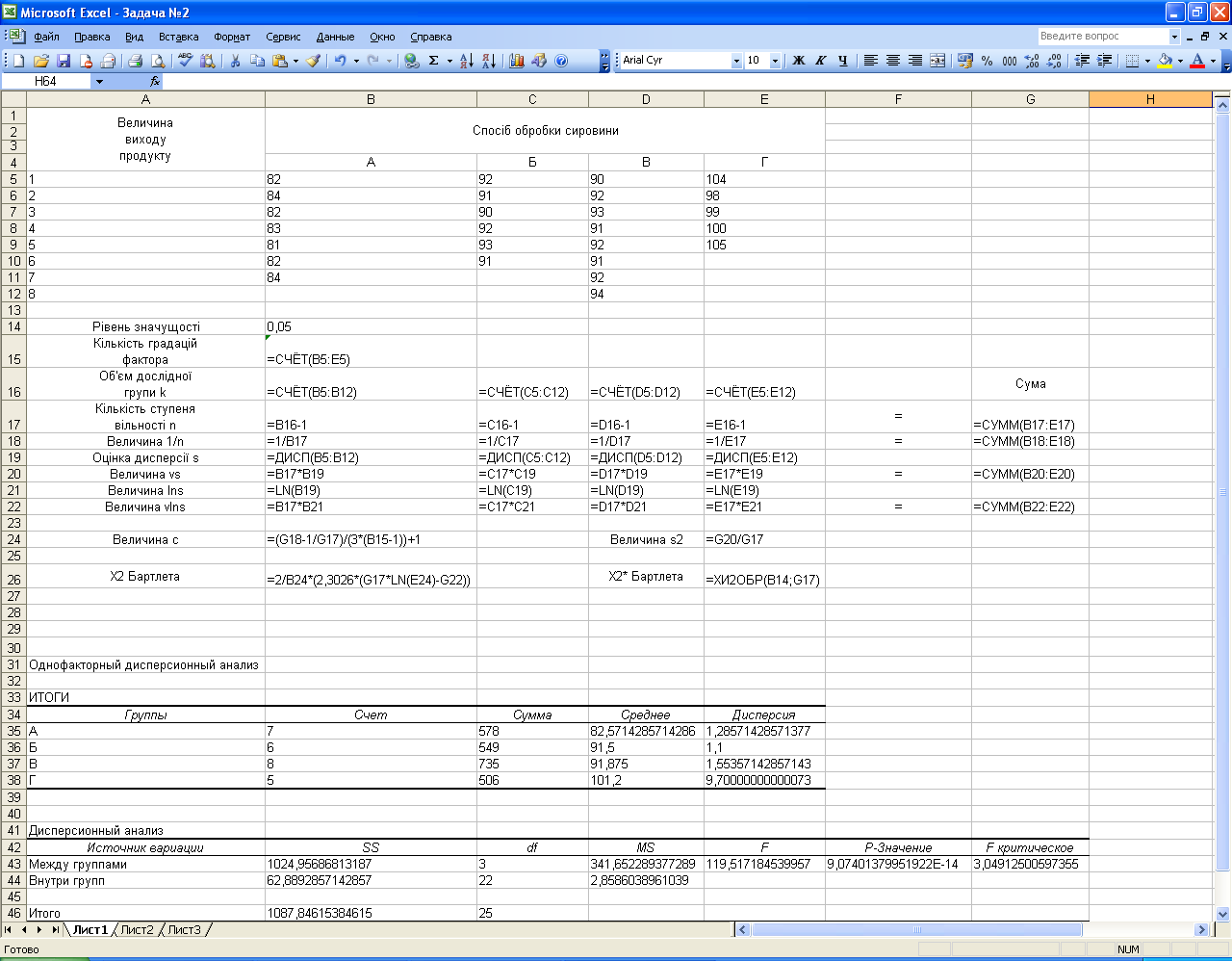
Мал. 1.3
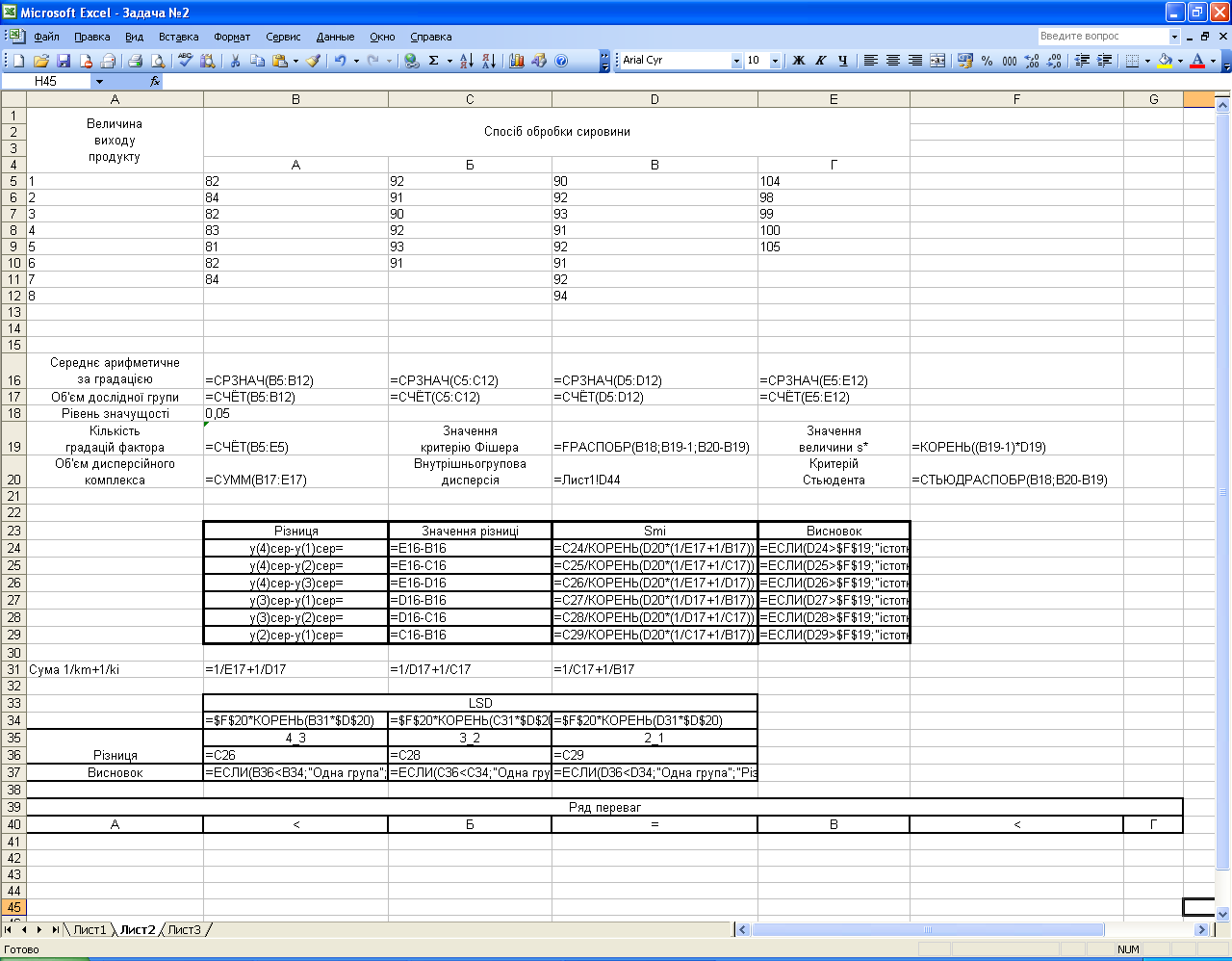
Мал. 1.4
Висновки
Оскільки має місце нерівність
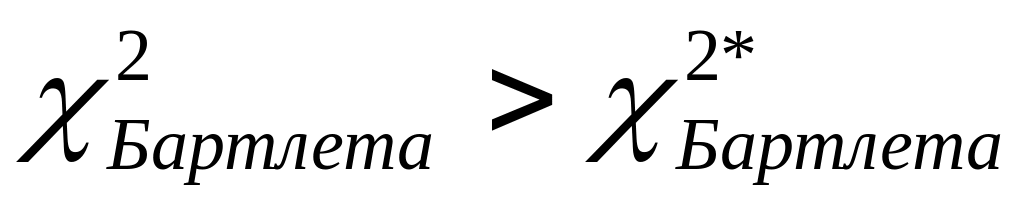 ,
тому дисперсії належать до однієї
генеральної сукупності, експеримент
є відтворюваним.
,
тому дисперсії належать до однієї
генеральної сукупності, експеримент
є відтворюваним.Оскільки має місце нерівність F > Fкритическое , тому досліджувані способи обробки сировини відрізняються з точки зору виходу продукту.
На підставі побудованого ряду переваг впливу градацій фактора на показник, що вивчається, можна стверджувати, що при способі А обробки сировини вихід продукту буде мінімальним.
Задача № 41
Скласти
і вирішити кінетичну модель простої
реакції першого порядку, яка протікає
за схемою
![]() .
.
Початкові
дані:![]() ;
;
![]()
Визначити час протікання реакції (час, за який речовини А стане менше 5 % початкової кількості).
Визначити,
при якій початковій концентрації
речовини А час реакції зменшиться в 1,8
разів з урахуванням того, що концентрація
речовини А на момент завершення реакції
залишиться без змін, тобто
![]() .
.
Визначити, при якій температурі протікання реакції її час зменшиться в 1,4 разів (енергія активації Е=4,215.103 Дж/моль).
Визначити кількість продукту S.
Побудувати графіки зміни концентрацій для речовин A і S.
Теоретична частина
У даний час машинні методи вирішення поставленої задачі, які передбачають здійснення моделювання процесу, що досліджується, за допомогою персонального комп'ютера, доцільно використовувати при вивченні кінетики фізико-хімічних процесів.
Під час комп'ютерного моделювання успішно вирішують задачі, для яких точний аналітичний розв'язок є неможливим, а наближений одержується достатньо складно, часто із значними витратами часу.
Процедура побудови кінетичної моделі складається з таких етапів:
• проведення експерименту;
• формування гіпотези про механізм реакції;
• побудова кінетичного рівняння на основі прийнятого механізму перебігу процесу;
• знаходження констант перебігу процесу;
• перевірка прийнятої гіпотези.
На першому етапі під час експериментальних досліджень збирають інформацію про процес, а також аналізують наявні теоретичні відомості.
На другому етапі, виходячи з експериментальних і теоретичних відомостей про процес, будують гіпотези про ймовірний механізм реакції.
На третьому етапі складають кінетичні рівняння, що описують обраний механізм перебігу процесу.
На четвертому етапі визначають константи перебігу процесу, що є коефіцієнтами вказаних рівнянь, а також обчислюють значення кінетичних характеристик, які відповідають умовам, за яких проводились експериментальні дослідження.
На п'ятому етапі, перевіряючи прийняту гіпотезу про механізм перебігу процесу, порівнюють експериментальні і розраховані дані, що одержані за тих самих умов на першому і четвертому етапах.
Якщо розбіжності між експериментальними і розрахованими значеннями є значними, то формулюють нову гіпотезу. Вибір вдалої гіпотези залежить як від кількості й якості інформації про досліджуваний процес, так і від досвіду дослідника.
Оскільки кінетичні закономірності хімічних перетворень можуть бути описані к одним або системою звичайних диференціальних рівнянь, тому реакція типу описується такою математичною моделлю (системою диференціальних рівнянь):
![]() ,
,
де
k(T) – константа швидкості реакції, числове значення якої визначають за рівнянням Арреніуса, а саме:
![]()
для
якого k0
– початкове
значення
константи швидкості реакції або
коефіцієнт пропорційності (при
![]() ),
Е
–
енергія активації, R
–
універсальна
газова
стала, Т – абсолютна температура.
),
Е
–
енергія активації, R
–
універсальна
газова
стала, Т – абсолютна температура.
Константа швидкості хімічної реакції вказує на те, з якою швидкістю протікає хімічна реакція при концентраціях реагуючих речовин, що дорівнюють одиниці.
У хімічній кінетиці константа швидкості реакції k є однією з основних величин разом зі швидкістю реакції.
Частинки, енергія яких більша або дорівнює Е, називаються активними, а параметр Е в зв'язку з цим називається енергією активації.
Для реакцій, що протікають в одну стадію, енергія активації показує, якою мінімальною енергією (в розрахунку на 1 моль) повинні володіти реагуючі частинки, щоб вони могли вступити в хімічну реакцію.
Для вирішення даної системи рівнянь відповідно до умови задачі можна використати систему Mathcad.
