
Сибирский Государственный Медицинский Университет Кафедра химии

Выполнил: студент группы 3705
Фармацевтический факультет
Борисов Борис
Проверила: доцент кафедры химии
Дрыгунова.Л.А
г. Томск
2008-2009 уч.год
Анализ смеси сухих солей.
Перед началом анализа мы были предупреждены о том, что в исследуемой соли могут находиться:
Катионы: NH4+, Na+, K+, Ba2+, Al3+, Zn2+, Mg2+, Mn2+, Fe3+, Cu2+, Co2+, Ni2+;
Анионы: SO42-, S2O32-, CO32-, HPO42-, B4O72-, Cl--, NO3-, CH3COO-- ;
1.Визуальное исследование образца:
Исследуемая соль состоит из голубовато-зеленых кристаллов, имеет чёткий запах уксуса, по структуре соль кристаллическая, неоднородная.
Вывод: после визуального исследования я могу предположить, что соль содержит ионы меди (т.к. имеет характерную окраску), возможно ионы никеля и так же могу сказать, что в исследуемой соли отсутствуют ионы Co2+, Mn2+, Fe3+, а так же хроматы и дихроматы.
2. Отбор средней пробы:
Средняя проба- это часть анализируемого вещества, отражающая его химический состав. Для проведения отбора средней пробы я поместил соль в фарфоровую ступку, предварительно протерев её спиртом, и проводил измельчение до тех пор, пока не получился мелкий порошок. Затем хорошо измельченную часть исследуемой соли
рассыпал тонким слоем на горизонтальной поверхности в виде квадрата, затем разделил его на четыре равные части. Соль из противоположных треугольников отобрал. Снова поместил в ступку и продел такую же процедуру еще два раза. Затем подготовленную для анализа среднюю пробу разделил на три части: одну часть буду
и спользовать
для анализа на анионы, другую - для
анализа на катионы, третью – для
предварительных испытаний и проверочных
определений.
спользовать
для анализа на анионы, другую - для
анализа на катионы, третью – для
предварительных испытаний и проверочных
определений.
Средняя проба
3. Предварительные испытания:
Окрашивание пламени: пропитываем вату спиртовым раствором, обмакиваем ее в соли и подносим к пламени газовой горелки. Пламя сначала окрашивается в желтый цвет, затем появилась голубая окраска.
Вывод: в исследуемой соли возможно присутствие катионов Na+ и Cu2+
Действие кислот на сухую соль: к небольшому количеству сухой средней пробы добавляем несколько капель раствора H2SO4. Выделение каких – либо газов не происходит, но чувствуется запах уксуса.
Вывод: в исследуемой соли скорее всего отсутствуют анионы S2O32-, CO32-, но присутствует CH3COO--.
Растворение сухого образца и обнаружение катионов.
К небольшому количеству средней пробы добавляем очищенную воду. Немного встряхиваем пробирку. Соль не растворилась в воде полностью. Начинаем нагревать эту пробирку ,соль также не растворяется в воде полностью. Тогда насыпаем в пробирку небольшое кол-во своей сухой и добавляем туда CH3COO-, соль полностью растворилась. Измеряем pH раствора, он равен 5,следовательно среда нейтральная.
Дробное обнаружение:
Обнаружение NH4+-ионов: в пробирку вносим 8-10 капель исследуемого раствора и прибавляем к нему 10 капель NaOH (2 моль/л). Затем раствор осторожно нагреваем, не допуская разбрызгивания. Над пробиркой помещаем влажную красную лакмусовую бумагу, которая синеет в парах. Чувствуется запах аммиака.
N H4CL
+ NaOH
NH3(г)
+ NaCL + H2O
H4CL
+ NaOH
NH3(г)
+ NaCL + H2O
Вывод: в исследуемой соли есть катионы NH4+;
Схема 1: Обнаружение катионов.
Раствор 1: катионы NH4+,
Na+, Cu2+.
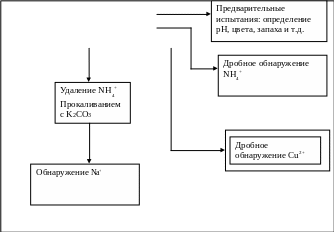
Обнаружение Fe2+- ионов: в пробирку помещаем 2-3 капли исследуемого раствора, прибавляем 1 – 2 капли HCl (2 моль/л) и по каплям раствор K3[Fe(CN)6]. Темно – синий осадок не образуется.
Вывод: в исследуемой соли нет катионов Fe2+;
Обнаружение Al3+- ионов: смачиваем фильтровальную бумагу р-ром K4[Fe(CN)6], подсушиваем её. Затем на эту бумагу наносим 1-2 капли исследуемого раствора, добавляем каплю воды и каплю уксусной кислоты. Держим бумагу над парами аммиака, затем тонким капилляром обводим пятно ализарином, снова держим над парами аммиака. Фиолетовая окраска не исчезает, красный цвет аллюминиевого лака не появляется.
Вывод: в исследуемой соли нет катиона Al3+;
Обнаружение Cu2+- ионов: в пробирку вношу 2 – 3 капли исследуемого раствора и прибавляю по каплям раствор аммиака (концентрированный). Раствор окрашивается в ярко – синий цвет.

 2CuSO4
+
4NH4OH
[Cu(NH3)4]SO4
+ 4H2O
2CuSO4
+
4NH4OH
[Cu(NH3)4]SO4
+ 4H2O
Вывод: в исследуемой соли присутствуют ионы Cu2+;
Обнаружение Ni2+ - ионов: в пробирку помещаем 3 - 4 капли исследуемого раствора, добавляем 3 – 4 капли раствора NH4OHконц. и 1 каплю спиртового раствора реактива Чугаева. Окрашивание раствора в розовый цвет не наблюдается, так же не выпадает ярко – красный осадок.
Вывод: в исследуемой соли нет катионов Ni2+;
Обнаружение Zn2+ - ионов: в пробирке смешиваем 5 капель исследуемого раствора и 5 капель раствора кобальт нитрата. Смесь нагреваем и кипятим около минуты. Горячим раствором смачиваем полоску фильтровальной бумаги, высушиваем её и сжигаем в фарфоровом тигле. Образование золы зеленого цвета не наблюдается.
Вывод: в исследуемой соли нет катионов Zn2+;
Обнаружение Mn2+ - ионов: в пробирку помещаем несолько капель
своего исследуемого раствора, к нему прибавляем 2-3 капли HNO3(разб)
и несколько крупинок сухой соли NaBiO3 ,окрашивания раствора
раствора в малиново-фиолетовый цвет не происходит
Вывод: в исследуемой соли нет катионов Mn2+;
Систематическое обнаружение:
2.1. К исследуемому раствору добавляем растворы разбавленной H2SO4 и 50% (от объёма исследуемого раствора) этилового спирта, осадок не выпал это говорит о том, что в исследуемом растворе отсутствуют катиона 3-ей аналитической группы.
Вывод: в исследуемой соли нет катионов Ba2+;
Обнаружение Na+ - ионов: к раствору 5 прибавляем 5 капель насыщенного раствора K2CO3, затем содержимое пробирки нагреваем над пламенем газовой горелки до кипения и кипятим до полного удаления аммиака. Смесь центрифугируем, отделяем осадок от раствора. Осадок 5 не исследуем. К раствору 7 добавляем 1 – 2 капли р-ра уксусной кислоты. Затем на предметное стекло наносим каплю полученного раствора, прибавляем 1 – 2 капли воды, немного упариваем до образования кристаллов по краям, рядом помещаем 2 капли пикриновой кислоты и стеклянной палочкой медленно соединяем их с сухим остатком. Затем исследуя предметное стекло под микроскопом, отчётливо видно длинные игольчатые кристаллы.
Вывод: в исследуемой соли присутствует катион Na+;
Обнаружение K+ - ионов: к раствору 5 прибавляем 5 капель насыщенного раствора Na2CO3, затем содержимое пробирки нагреваем над пламенем газовой горелки до кипения и кипятим до полного удаления аммиака. Смесь центрифугируем, отделяем осадок от раствора. Осадок 4 не исследуем. К раствору 6 добавляем 1 – 2 капли р-ра уксусной кислоты. Затем к 2 – 3 каплям исследуемого раствора добавляем 2 капли раствора водород тартрата и потираем стенки пробирки стеклянной палочкой. Выпадение осадка не происходит.
Вывод: в исследуемой соли нет катионов K+;
Обнаружение Mg2+- ионов: к исследуемому раствору прибавляем NaOH, выпадает осадку, к этому осадку добавляем NH4Cl(сух), смесь нагреваем, после охлаждения осадок и раствор центрифугируем. К 2 – 3 каплям раствора добавляем несколько капель NH4OH и Na2HPO4, белого кристаллического осадка не образовалось.
Вывод: в исследуемой соли нет катионов Mg2+;
Анализ сухой соли на анионы:
1. Предварительные выводы: при подкислении раствора ощущается четкий запах уксуса, соль растворяется в CH3COOH.
Вывод: в исследуемой соли скорее всего из анионов неустойчивых кислот присутствует CH3COO- .
Подготовка исследуемого раствора к анализу анионов: часть средней пробы растворяем в воде, помещаем в фарфоровую чашку и добавляем насыщенный раствор Na2CO3 (для удаления катионов тяжелых металлов). Осторожно кипятим содержимое в течении 10 – 15 минут. Осадок и раствор переносим в коническую пробирку и центрифугируем.В осадке получаем:
2CuSO4 + 2CO3- + H2O = (CuOH2)CO3(ТВ) + 2SO42- + CO2(г)
Вывод: проведя данную операцию мы избавились от «тяжелых» металлов и подготовили раствор для проведения дробного и систематического анализа.
Анализ анионов: схема 2:
Предварительные испытания
Р – р 1: SO42-,
Cl--,
CH3COO--
Дробное обнаружение: CH3COO--

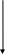

Дробное обнаружение SO42-;

Осадок AgCl
Растворение осадка AgCl
