
- •С.В. Горожанцев взрывные работы в сейсморазведке
- •Содержание
- •Введение
- •1. Общие сведения
- •1.1. Сейсморазведка – геофизический метод поисков и разведки полезных ископаемых [4, 6, 7]
- •1.2. Факторы, определяющие упругие свойства геологической среды [2, 4, 6, 7, 12]
- •Классификация грунтов (пород) по м.М. Протодьяконову и сНиПу
- •2. Взрыв – источник упругих колебаний
- •2.1. Краткие исторические сведения [1, 11]
- •2.2. Понятие о взрыве и взрывчатых веществах (вв) [1, 9, 10, 11]
- •2.3. Кислородный баланс, состав и вредность газообразных продуктов взрыва 6, 9
- •2.4. Определение объема, давления и теплоты газов при взрыве [6]
- •2.5. Начальный импульс и чувствительность 1,6,9
- •2.6. Скорость и виды взрывчатых превращений 1,6,9
- •2.7. Фугасное, бризантное и кумулятивное действие взрыва 6
- •2.8. Основные свойства взрывчатых веществ (вв) 5,6,9,11
- •Энерговыделяющие композиции на основе алюминия и аммиачной селитры
- •3. Взрывчатые вещества и средства инициирования (взрывания) (вм)
- •3.1 Классификация вв 5,6,9
- •3.2. Промышленные вв 6,9,10,11
- •3.2.1. Бризантные взрывчатые вещества
- •3.2.2. Инициирующие взрывчатые вещества
- •3.2.3. Метательные вв
- •3.3. Средства инициирования (взрывания) 6,9,11
- •4. Основные параметры, определяющие сейсмическую эффективность взрыва 9,10,12
- •5. Оборудование для взрывных работ 6,11,12
- •Общие правила ведения взрывных работ 5,6
- •7. Персонал для взрывных работ 6,13
- •8. Техника выполнения взрывных работ 6
- •9. Ликвидация отказавших зарядов, уничтожение вм, ликвидация последствий взрыва 5,6
- •10. Хранение и транспортировка вм 5,6,9,14
- •11. Общие правила безопасности 5,6,16
- •Приложение 1 Руководство для решения некоторых видов задач по взрывному делу (по Ассонову в.А.)
- •1. Характеристика взрывчатого превращения вв
- •2. Теория процесса детонации
- •3. Расчет безопасных расстояний.
- •Приложение 2 Примерный перечень вопросов к зачету
- •Библиографический список
2.3. Кислородный баланс, состав и вредность газообразных продуктов взрыва 6, 9
Прежде всего нужно оценить энергию (количество тепла), выделяющуюся при взрыве. Реакции бывают двух типов - с выделением тепла (экзотермические) и с поглощением (эндотермические). Теплоты образования молекул - соединений из атомов (теплота образования последних равна нулю) могут быть как отрицательные (на их образование из элементов нужно дополнительно тратить энергию), так и положительные. Выделение тепла у ВВ обычно вызывается реакцией между горючими составляющими и окислителем (кислородом), входящим в его состав. Если ВВ - индивидуальное химическое соединение, то ими будут разные группы в молекуле, если смесовое - разные вещества, входящие в состав смеси. Их соотношение определяет кислородный баланс вещества.
Процентное отношение фактического количества кислорода, находящегося в составе данного ВВ, к количеству кислорода, необходимого для полного окисления всех горючих элементов (углерода - в углекислый газ, водорода - в воду), называется кислородным балансом. Кислородный баланс может быть нулевым, положительным и отрицательным.
Взрывчатые вещества, содержащие кислород в таком количестве, какое необходимо для полного окисления с превращением углерода в углекислый газ и водорода в воду, называются ВВ с нулевым кислородным балансом. Если в составе ВВ кислорода больше, чем его требуется для окисления всех горючих элементов, то эти ВВ считаются с положительным кислородным балансом. И, наоборот, ВВ, содержащие недостаточное количество кислорода для полного окисления горючих элементов, являются ВВ с отрицательным кислородным балансом.
Величина положительного или отрицательного кислородного баланса определяется как соотношение между весом избытка или недостатка кислорода и общим весом частиц вещества, принимающих участие в процессе взрывчатого превращения. Взрывчатые вещества, обладающие нулевым кислородным балансом, имеют большое практическое значение в промышленности. Они образуют максимальное количество полезной энергии при наименьшем выделении ядовитых газов. Взрывчатые вещества с небольшим положительным кислородным балансом также обладают хорошим эффектом при взрыве. Незначительный избыток кислорода в их составе используется для уравновешивания баланса при случаях вступления в реакцию материалов, изолирующих ВВ.
В практике взрывного дела применяется простейший способ определения кислородного баланса ВВ (табл. 2). Для этого необходимо знать наименование компонентов ВВ, их процентное отношение к общему составу и кислородный баланс каждого компонента. Например, в состав аммонита № 6 входят аммиачная селитра в количестве 79% (кислородный баланс +20) и тротил 21% (кислородный баланс - 74). В результате подсчета имеем следующие значения:
для
79% аммиачной селитры
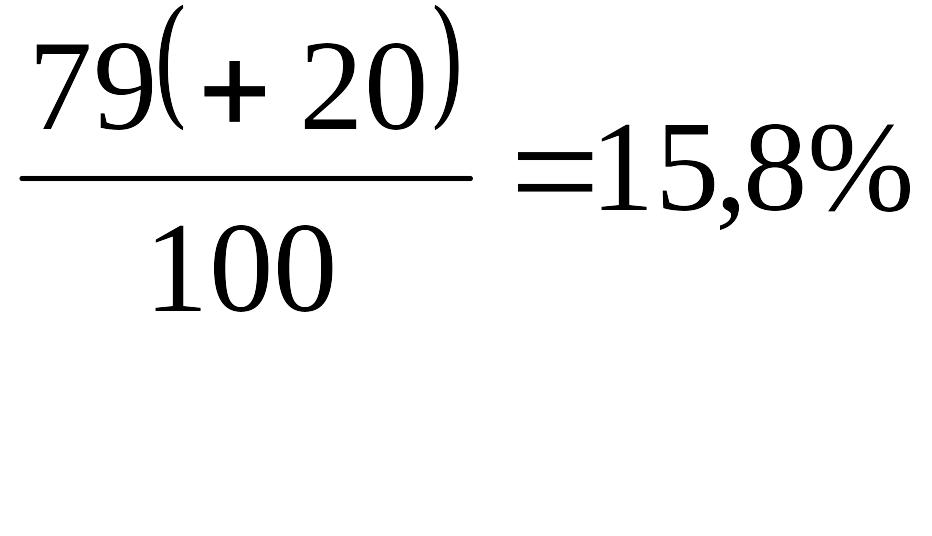 ,
,
для
21% тротила
![]() .
.
Кислородный баланс аммонита № 6 составляет: 15,8 + (-15,54) =0,26, или округленно 0,3%.
Таблица 2
Кислородный баланс отдельных веществ
Вещество |
Кислородный баланс, % |
Вещество |
Кислородный баланс, % |
Аммонит АП-5ЖВ…………... Динитрогликоль …………….. Динафталит,……………......... Аммонал ВА-2……………… Нефтяной аммонит № 2…… Скальный аммонит №2……... Аммонит № 7 ЖВ………….. Аммонит № 6………………. 62%-ный динамит, труд-нозамерзающий……………… Аммонит № 7………………... Аммонит № 9………………. Аммонит № 10……………... Аммиачная селитра………….. Нитроглицерин………………. |
0 0 0 0 +0,1 +0,13 +0,2 +0,3
+0,3 +0,55 +2,9 +1,5 +20 +3,5 |
Тэн………………………… Гремучая ртуть………….. Гексоген………………….. Коллодионный хлопок…... Тетрил…………………….. Тенерес……………………. Тротил…………………….. Алюминий………………… Бумага……………………... Древесная мука………….. Хлопковый жмых………… Торф ……………………… Асфальтит………………… Парафин………………….. |
- 10,1 - 11,3 - 21,6 - 33,6 - 47,4 -56 - 74 - 89 - 116,1 - 125 - 151,2 - 153 - 329 - 345,4 |
Основными компонентами большинства взрывчатых веществ являются: углерод, кислород, водород и азот. При этом в составе каждого ВВ имеется количество кислорода, достаточное для окисления горючих элементов в процессе взрыва. Наряду с образованием воды (Н20), углекислого газа (СО2) и выделением азота (N) в итоге взрывчатого превращения всегда образуются ядовитые газы: окись углерода (СО), закись азота (N20), окись азота (NО), сероводород (Н2S) и сернистый газ (SO2). Образование сероводорода и сернистого газа возможно только при взрывах в породах, содержащих серу.
Состав газообразных продуктов взрыва зависит от ряда факторов: химического состава ВВ, технологии его изготовления, веса заряда, изолирующей оболочки, характера горных пород, условий взрывания и др.
Количество и состав ядовитых газов в продуктах взрыва определяются характером и величиной кислородного баланса, количеством гидроизоляционного материала (отдельно патронов, шашек и в целом заряда ВВ), величиной частиц отдельных компонентов, степенью влажности, слежалости и плотностью ВВ, величиной коэффициента использования скважины, местом расположения патрона-боевика или электродетонатора, материалом забойки, условием взрыва, характером горных пород и др.
Взрывчатые вещества с пулевым кислородным балансом рассчитаны при нормальном взрыве на полное окисление углерода и водорода; первый переходит в углекислоту, второй - в пары воды, и азот выделяется в свободном состоянии. Однако даже при нормальной детонации процесс взрывчатого превращения протекает далеко не идеально. Помимо полного окисления горючих элементов образуются ядовитые газы (окись углерода и окислы азота). Дополнительные окиси углерода создаются за счет гидроизоляционных материалов ВВ, парафина и бумаги. Кроме того, при условии затухания детонации и перехода ее к горению образуется большое количество окислов азота.
Взрывчатые вещества с отрицательным кислородным балансом создают большое количество окиси углерода, а при положительном балансе - много окиси азота. Количество и вредность ядовитых газов зависят от физического состояния и химического состава горных пород, в которых производятся взрывы.
Количество ядовитых газов в продуктах взрывчатого превращения колеблется от 15 до 100 л и более на 1 кг ВВ (в переводе на условную окись углерода). По вредности газы имеют следующие соотношения: 2 л сероводорода или сернистого газа равны 5 л окиси углерода, а 2 л окислов азота равны 13 л окиси углерода.
В момент производства взрывных работ в шурфах, на поверхности земли (накладные заряды) и в воздухе (подвесные заряды) бригаде взрывников необходимо располагаться с надветренной стороны, чтобы газообразные продукты взрыва относились ветром в противоположную сторону. При взрывах в шурфах и повторном их заряжании спускать людей разрешается только после тщательной проверки шурфов на отсутствие в них ядовитых газов. Нередки случаи, когда физическое состояние атмосферы способствует длительной задержке в шурфах окиси углерода и окислов азота. Заряжание таких шурфов допускается лишь после удаления газов. Окислы азота можно нейтрализовать орошением шурфа водой. Вода поглощает окислы азота и, конденсируясь, оседает на стенках шурфа. Окись углерода можно удалить из шурфа только при помощи струи сжатого воздуха путем продувания (проветривания).
Ядовитые газы продуктов взрывчатого превращения различаются рядом присущих им особенностей.
Окись углерода не имеет цвета, запаха и вкуса, горит синим пламенем. При появлении окиси углерода в воздухе ощущается запах сопутствующих ей газов и мельчайших частиц пыли. Содержание в воздухе окиси углерода более чем 0,02 мг/л (0,0016% объема) при длительном воздействии на организм человека может вызвать тяжелые последствия.
Сероводород бесцветен, но обладает характерным запахом тухлых яиц, очень ядовит. Концентрация сероводорода в воздухе более чем 0,00069% объема, считается вредной для организма человека.
Сернистый газ бесцветен, но имеет резко раздражающий запах. Концентрация сернистого газа в воздухе более чем 0,0007% объема отрицательно сказывается на организм человека.
Окислы азота имеют цвет желто-бурых паров, окраска которых усиливается с повышением температуры. Они обладают резким характерным запахом. Концентрация окислов азота в воздухе более чем 0,00025% объема при длительном воздействии на организм человека сказывается отрицательно. Окислы азота относятся к числу наиболее ядовитых газов.
