
- •Содержание:
- •Введение
- •Общие сведения элемента
- •Актиноид или d-элемент?
- •История открытия
- •Нахождение в природе
- •Физические свойства
- •Токсические свойства
- •Ядерно – химические свойства
- •Химические свойства:
- •Металлического протактиния
- •Соединения протактиния
- •Ядерные свойства
- •Получение элемента
- •Экстракция
- •Расчетная часть
- •Список литературы:
Нахождение в природе
Протактиний
– крайне малораспространенный элемент.
Даже у долго живущего природного изотопа
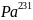 (Т=32480 лет) продолжительность жизни
ничтожно мала по сравнению с возрастом
Земли. Этот изотоп постоянно образуется
при распаде
(Т=32480 лет) продолжительность жизни
ничтожно мала по сравнению с возрастом
Земли. Этот изотоп постоянно образуется
при распаде
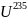 и
находится с ним в радиоактивном
равновесии. По мере распада
в земной коре пропорционально уменьшается
и содержания протактиния. Например, 4,5
миллиарда лет назад содержания протактиния
было в 16 раз больше, чем в современную
геологическую эпоху. Общее содержание
протактиния в земной коре согласно
оценке содержания урана, определяемого
в 1,3·
и
находится с ним в радиоактивном
равновесии. По мере распада
в земной коре пропорционально уменьшается
и содержания протактиния. Например, 4,5
миллиарда лет назад содержания протактиния
было в 16 раз больше, чем в современную
геологическую эпоху. Общее содержание
протактиния в земной коре согласно
оценке содержания урана, определяемого
в 1,3·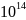 т,
составляет 4,4·
т,
составляет 4,4·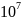 т.
По последним данным, содержание
протактиния в земной коре соответствует
1·
т.
По последним данным, содержание
протактиния в земной коре соответствует
1·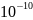 %
по массе. Содержания протактиния в
горных породах вулканического
происхождения составляет 0,8·
%
по массе. Содержания протактиния в
горных породах вулканического
происхождения составляет 0,8·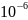 г/т, а в железных метеоритах 0,02·
г/т.
По другим сведеньям, граниты содержат
0,46·
г
на 1 т породы, а каменные метеориты
0,035·
г/т.
Радионуклиды
протактиния входят в состав естественных
радиоактивных рядов урана-235 и урана-238
(ядерные изомеры 234-Ра, Т1/2 = 6,7 часа и
менее устойчивый 234-Pa). В 1 т урана в
урановых около 0,3 г протактиния-231.
г/т, а в железных метеоритах 0,02·
г/т.
По другим сведеньям, граниты содержат
0,46·
г
на 1 т породы, а каменные метеориты
0,035·
г/т.
Радионуклиды
протактиния входят в состав естественных
радиоактивных рядов урана-235 и урана-238
(ядерные изомеры 234-Ра, Т1/2 = 6,7 часа и
менее устойчивый 234-Pa). В 1 т урана в
урановых около 0,3 г протактиния-231.
Физические свойства
Протактиний
— светло-серый металл, по твёрдости
приближающийся к урану. Металлический
протактиний существует в двух модификация
При температуре 2К обладает
сверхпроводимостью. Металлический
протактиний кристаллизуется в
тетрагональной сингонии. При 1170 ͦ С
существует объёмно-центрированная
кубическая модификация. Протактиний
на воздухе обычно покрывается тонкой
плёнкой монооксида. Плотность 15,37 г/
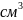 ,
tпл около 1570°C, t кип.=4500 ͦ С.
,
tпл около 1570°C, t кип.=4500 ͦ С.
Токсические свойства
Как
и все α-излучатели со сравнительно
небольшим периодом жизни,
представляет опасность для организма.
При попадании в организм он склонен
накапливаться в почках и костях.
Максимальное безопасное количество
протактиния при попадании внутрь
организма человека составляет 0,03 мккюри,
что соответствует 0,5 мкг
.
Протактиний-231, содержащийся в воздухе
в виде аэрозолей, в 2,5·
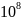 раз токсичнее, чем синильная кислота(при
одинаковых их концентрациях). Поэтому
все работы с весовыми количествами
проводятся в специальных изолированных
боксах.
раз токсичнее, чем синильная кислота(при
одинаковых их концентрациях). Поэтому
все работы с весовыми количествами
проводятся в специальных изолированных
боксах.
Ядерно – химические свойства
Химические свойства:
Металлического протактиния
Металлический
протактиний был впервые получен Гроссе
и Агруссом бомбардировкой электронами
с энергией 35 кэв в высоком вакууме
пятиокиси протактиния, нанесенной на
медную мишень. А также термическим
разложением галогенидов протактиния
(хлорида, бромида и иодида) на вольфрамовой
нити при повышенной температуре и
давлении 1·
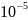 -
1·
мм рт. ст. Металлический протактиний
получен восстановлением РаF4
парами бария или кальция при 1400-1500 ͦ С.
Имеются данные, что протактиний
осаждается в виде тонкой пленкой на
металлических пластинах (Zn,
Al,
Mn
и др.) из разбавленных растворов HF
и H2SO4.
Легко реагирует с водородом при 250-300
ͦ С, образуя черный гидрид РаН3,
изоструктурный с UН3.
С иодом металлический протактиний
образует летучие соединения, которые
не были идентифицированы. Протактиний
не образует амальгамы.
-
1·
мм рт. ст. Металлический протактиний
получен восстановлением РаF4
парами бария или кальция при 1400-1500 ͦ С.
Имеются данные, что протактиний
осаждается в виде тонкой пленкой на
металлических пластинах (Zn,
Al,
Mn
и др.) из разбавленных растворов HF
и H2SO4.
Легко реагирует с водородом при 250-300
ͦ С, образуя черный гидрид РаН3,
изоструктурный с UН3.
С иодом металлический протактиний
образует летучие соединения, которые
не были идентифицированы. Протактиний
не образует амальгамы.
Металлический протактиний бурно реагирует в первый момент с 6Н НСl, но за тем реакция быстро прекращается. Добавление HF вначале способствует растворению протактиния, однако реакция также быстро прекращается. При этом металл покрывается гелеобразно пленкой. В смеси HF и НСl металлический протактиний не растворяется.
