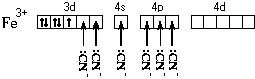- •Глава 17.Комплексные соединения
- •17.1. Основные определения
- •17.2. Классификация комплексных соединений
- •17.3. Основы номенклатуры комплексных соединений
- •17.4. Химическая связь в комплексных соединениях и их строение
- •17.5. Химические свойства комплексных соединений
- •17.6. Изомерия комплексных соединений
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
17.3. Основы номенклатуры комплексных соединений
Формула комплексного соединения составляется также, как и формула любого ионного вещества: на первом месте записывается формула катиона, на втором – аниона.
Формула комплексной частицы записывается в квадратных скобках в следующей последовательности: на первом месте ставится символ элемента-комплексообразователя, далее – формулы лигандов, бывших до образования комплекса катионами, затем – формулы лигандов, бывших до образования комплекса нейтральными молекулами, и после них – формулы лигандов, бывших до образования комплекса анионами.
Название комплексного соединения строится также, как и название любой соли или основания (комплексные кислоты называются солями водорода или оксония). В название соединения входит название катиона и название аниона.
В название комплексной частицы входит название комплексообразователя и названия лигандов (название записывается в соответствии с формулой, но справа налево. Для комплексообразователей в катионах используются русские названия элементов, а в анионах – латинские.
Названия наиболее распространенных лигандов:
H2O – аква |
Cl – хлоро |
SO42 – сульфато |
OH – гидроксо |
CO – карбонил |
Br – бромо |
CO32 – карбонато |
H – гидридо |
NH3 – амин |
NO2 – нитро |
CN – циано |
NO – нитрозо |
NO – нитрозил |
O2 – оксо |
NCS – тиоцианато |
H+I – гидро |
Примеры названий комплексных катионов:
[Zn(H2O)4]2 – ион тетрааквацинка |
[Fe(H2O)5Cl]2 – ион хлоропентаакважелеза(III) |
[Ag(NH3)2] – ион диамминсеребра(I) |
[Al(H2O)4(OH)2] – ион дигидроксотетраакваалюминия |
[Cr(H2O)6]3 – ион гексааквахрома(III) |
[Co(NH3)5SO3] – ион сульфитопентаамминкобальта(III) |
Примеры названий комплексных анионов:
[Zn(OH)4]2 – тетрагидроксоцинкат-ион [Ag(S2O3)2]3 – ди(тиосульфато)аргентат(I)-ион [Cr(CN)6]3 – гексацианохромат(III)-ион [Al(H2O)2(OH)4] – тетрагидроксодиакваалюминат-ион [Co(NH3)2(NO2)4] – тетранитродиамминкобальтат(III)-ион [Fe(H2O)(CN)5]3 – пентацианоакваферрат(II)-ион
Примеры названий нейтральных комплексных частиц:
[Fe(CO)5] – пентакарбонилжелезо |
[Cr(C6H6)2] – дибензолхром |
[Co(NH3)Cl3] – трихлороамминкобальт |
[Pt(NH3)2Br2] – дибромодиамминплатина |
Более подробные номенклатурные правила приводятся в справочниках и специальных пособиях.
17.4. Химическая связь в комплексных соединениях и их строение
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму (как следствие – с изменением формальных зарядов). В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции:
FeCl2кр + 6H2O = [Fe(H2O)6]2 + 2Cl
Электронная формула атома железа – 1s22s22p63s23p64s23d6. Составим схему валентных подуровней этого атома:
![]()
При образовании двухзарядного иона атом железа теряет два 4s-электрона:
![]()
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:

Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:

Пространственное строение этой частицы выражается одной из пространственных формул:
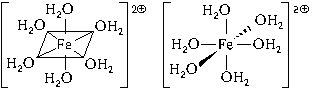
Форма координационного полиэдра – октаэдр. Все связи Fe-O одинаковые. Предполагается sp3d2-гибридизация АО атома железа. Магнитные свойства комплекса указывают на наличие неспаренных электронов.
Если FeCl2 растворять в растворе, содержащем цианид-ионы, то протекает реакция
FeCl2кр + 6CN = [Fe(CN)6]4 + 2Cl .
Тот же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN:
[Fe(H2O)6]2 + 6CN = [Fe(CN)6]4 + 6H2O .
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. Кроме того магнитные свойства цианидного комплекса указывают на отсутствие неспаренных электронов у атома железа. Все это связано с несколько иным электронным строением этого комплекса:
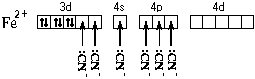
Более " сильные" лиганды CN образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы " нарушить" правило Хунда и освободить 3d-орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d2sp3.
" Сила" лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации ЭО и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их " силы" (своеобразный " ряд активности" лигандов), этот ряд называется спектрохимическим рядом лигандов:
I ; Br ; :SCN , Cl , F , OH , H2O; :NCS , NH3; SO3S:2 ; :CN , CO |
Для комплексов [Fe(H2O)6]3 и [Fe(CN)6]3 схемы образования выглядят следующим образом:
|
|
Для комплексов с КЧ = 4 возможны две структуры: тетраэдр (в случае sp3-гибридизации), например, [Zn(H2O)4]2 , и плоский квадрат (в случае dsp2-гибридизации), например, [Cu(NH3)4]2 .