- •Мелатонин
- •II. Введение. История развития и современное состояние изучения данного
- •2. Строение эпифиза.
- •3.2. Регуляция синтеза мелатонина.
- •3.5.2. Влияние эпифиза на функции гипофиза.
- •3.5.3. Влияние эпифиза на функции щитовидной железы.
- •3.5.4. Влияние эпифиза на функции надпочечников.
- •3.5.5. Влияние эпифиза на функции околощитовидных желёз.
- •3.6. Эпифиз и психика.
- •3.7. Эпифиз и канцерогенез.
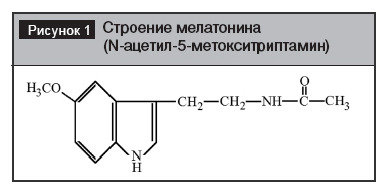
Биологическая роль мелатонина и его клиническое применение Впервые Мелатонин был выделен в 1958 г. А. Лернером [8]. Мелатонин является индольным производным серотонина (рис.1).
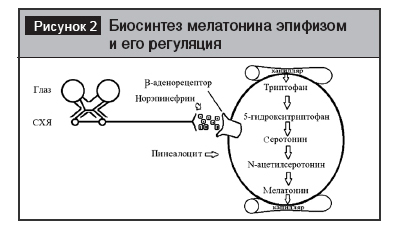
Биосинтез мелатонина эпифизом и его регуляция. Световая информация от клеток сетчатки передается на нейроны супрахиазматических ядер (СХЯ) гипоталамуса. Затем – на ствол верхней грудной части спинного мозга, симпатические нейроны верхнего шейного ганглия и в эпифиз. В темноте сигналы от СХЯ инициируют синтез и высвобождение норэпинефрина. Он возбуждает рецепторы в мембранах пинеалоцитов. Следствием этого является поступление в них из сосудистого русла триптофана. Из него образуется серотонин. Он ацетилируется до N-ацетилсеротонина с последующим превращением в М [1–11] (рис. 2).
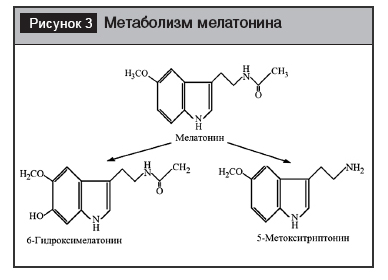
В тканях мелатонин распределен неравномерно. Регистрируется градиент концентрации между клетками ЦНС (высокий уровень), кровью и другими тканями (низкий уровень) [40, 41, 83]. Фармакокинетика эпифизарного мелатонина.После биосинтеза пинеалоцитом М выделяется в спинномозговую жидкость и затем в кровь. Благодаря своим амфифильным свойствам, М беспрепятственно проходит через клеточные мембраны. В крови связывается с альбумином [40, 72, 85]. Распределяется в организме, накапливается в гипоталамусе. М гидроксилируется в печени до 6-гидроксимелатонина и 5-метокситриптамина (рис. 3) [12]. Содержание последнего метаболита в моче является маркёром скорости секреции М эпифизом [2, 4].
Фармакодинамика мелатонина. Эффекты, вызываемые М, опосредованы его действием на специфические рецепторы, а также нерецепторными механизмами [3]. Рецепторы мелатонина.Онилокализуются в толще плазматической и ядерной мембран клеток-мишеней. Их антагонистом является лузиндол [30, 66, 108]. В плазматической мембране охарактеризованы 3 типа рецепторов М: МТ1 (М-1a, MTNR1A), МТ2 (M-1b, MTNR1B) и МТ3 (M-1c, МТNR1C) [28, 87–89]. У человека выявлены два первых типа [8, 100]. Они относятся к классу серпентинных рецепторов и сопряжены с G-белками [28, 86–88]. МТ1 рецепторы обнаружены в гипоталамусе (СХЯ), передней доле гипофиза, кишечнике, почках, клетках меланомы. MТ2 – в легких, сетчатке, ЦНС. Установлено, что они регулируют циркадные ритмы [8, 99]. В ядерной мембране рецепторы М относятся к RZR/ROR ретиноидным рецепторам [18, 20, 23, 61, 109]. Нерецепторный ме-ханизм действия мелатонина.М – мощный антиоксидант. Он связывает свободные радикалы кислорода, активирует супероксиддисмутазу, каталазу, глутатионпероксидазу. Последняя катализирует превращение восстановленного глутатиона в окисленный [2–4]. М ингибирует активность NO-синтетазы, катализирующей образование цитотоксичных NO- радикалов [24]. Кроме М, выраженным антиоксидантным действием обладает также и 6-гидроксимелатонин [3]. Гомеостаз мелатонина.Все клетки, продуцирующие М, – компоненты диффузной нейроэндокринной системы. Она состоит из центрального (эпифиз, сетчатка, СХЯ) и периферического (см. выше) компонентов. Секреция М клетками центрального компонента совпадает с ритмом “свет–темнота”, периферического – не зависит от освещенности [8]. У взрослого человека синтезируется » 30 мг в сутки М [3]. Его концентрация в плазме ночью (максимальный уровень – в 2 часа) в 30 раз выше, чем днем [32, 40, 76, 118]. У детей концентрация М в плазме постепенно нарастает до 1 года и сохраняется на этом высоком уровне до периода полового созревания. Затем уровень М постепенно снижается [2]. Суточный циркадный ритм синтеза М регистрируется даже у новорожденных. У недоношенных он формируется через 2 – 3 недели после родов [8]. У людей старше 60 лет функция эпифиза угнетается [2].Синхронно плавно и медленно снижается концентрация М (максимально на 50%) [26, 34, 46, 58, 62, 63, 97]. Однако у 33% людей старше 70 лет выявлены высокие, характерные для молодых, уровни М в плазме [8]. Регуляция секреции мелатонина. Концентрация М в плазме повышается после введения триптофана, антидепрессантов (ингибиторы МАО), кислоты никотиновой и пиридоксина, солей кальция и магния. Медитация [3], умеренные физические нагрузки и сон (в положении на спине) [8] сопровождаются увеличением содержания М. Содержание М снижается после назначения высоких доз цианокоболамина, кофеина или продуктов, его содержащих (кофе, чай, кока-кола), парацетамола, резерпина, флуоксетина, дексаметазона, кислоты ацетилсалициловой и других НПВС, атенолола, нифедипина. Курение и потребление алкогольных напитков (особенно после 19 часов) также способствуют его снижению [3]. У людей, подвергающихся воздействию магнитных полей низкой частоты и низкочастотному электромагнитному излучению (электрики), регистрируется низкий уровень М в плазме [8]. Токсичность мелатонина. LD50 мелатонина для крыс при введении внутрь – 800 мг/кг. Парентерально введенный М проникает через гематоэнцефалический барьер, накапливается в ликворе и нейронах ЦНС [3, 4, 48]. Мелатонин – малотоксичное, безопасное лекарственное средство, что подтверждено рандомизированными «слепыми» плацебоконтролируемыми исследованиями [44, 101, 102]. Клинически важные эффекты комбинации мелатонина с другими лекарственными средствами Лекарственные средства, регулирующие функции ЦНС Леводопа. М увеличивает биодоступность и эффективность леводопы, тормозит её биотрансформацию [91]. Галоперидол. М (1, 2, 5 мг/кг) препятствует развитию тардивной дискинезии у больных шизофренией, леченных галоперидолом. Эффект дозозависим. При изучении механизма этого действия у крыс установлено, что М снижает интенсивность реакций перекисного окисления липидов (ПОЛ), повышает уровень восстановленного глутатиона (ГSН), активность супероксиддисмутазы (СОД) и каталазы в нейронах ЦНС [68]. Карбамазепин, фенитоин, фенобарбитал. Введение крысам М (50 мг/кг) с этими лекарственными средствами (за 60 минут до моделирования судорог электрошоком) позволяет снизить их дозы с одновременным повышением противосудорожного действия » на 50 %. Важно, что М не влияет на концентрацию этих противосудорожных лекарственных средств в крови и головном мозге [36, 49]. Морфин. Мелатонин усиливает анальгезирующее действие морфина, а также снижает толерантность к нему и проявления зависимости. Это позволяет снизить дозу морфина [39]. Применение антагониста мелатониновых МТ2 рецепторов лузиндола [38] и периферических бензодиазепиновых рецепторов [78, 79], а также ингибиторов NO-синтетазы [69, 78, 79] предотвращает развитие этих эффектов М. Клонидин. Комбинация М с клонидином обладает анальгезирующим действием при послеоперационных болях [111]. Суксаметоний. М не влияет на сократимость мышц, однако его использование с суксаметонием значительно усиливает его миорелаксантное действие [105]. Пропофол и тиопентал. Комбинация М (внутрь, 200 мг/кг) с вышеуказанными лекарственными средствами приводит к потенцированному синергизму и, как следствие, значительному снижению их доз [67]. Тиопентал и кетамин. М (20 мг/кг, в желудок, однократно) сокращает начало развития и удлиняет общую анестезию у крыс [27]. Бензодиазепины. М проявляет потенцированный синергизм с бензодиазепинами при лечении малосонницы. Это позволяет снизить дозы последних » на 50% в течение недели и, затем, полностью прекратить их приём через 5 – 6 недель, что чрезвычайно важно для больных с зависимостью от бензодиазепинов [33]. Вальпроат. У больных эпилепсией, получавших низкие (неэффективные) дозы вальпроата, дополнительное назначение М (3 – 9 мг/сутки) приводит к выраженному противосудорожному действию [35, 74]. Спирт этиловый. Основную роль в развитии алкогольного поражения печени играют свободные радикалы кислорода и фактор некроза опухолей-a. Введение М приводит к снижению их содержания в печени и плазме. Это сопровождается улучшением структуры и функции печени (снижается выраженность некроза, инфильтрация печени нейтрофилами, активность аминотрансфераз в плазме) [46, 80]. Лекарственные средства, регулирующие функции ССС Ингибиторы АПФ. При комбинации с М усиливается их гипотензивное действие. В механизме такого действия М играет роль блокада транспорта Са+ в гладкомышечные клетки сосудов. Последние расширяются, снижается общее периферическое сопротивление. Это приводит к снижению систолического, диастолического и среднего артериального давления. В конечном итоге снижаются энергетические затраты миокарда и он переходит на более экономный режим работы [7, 9, 116, 117]. Антагонисты рецепторов ангиотензина-ІІ. Их комбинация с М сопровождается усилением гипотензивного действия и улучшением состояния больных за счет снижения частоты и выраженности побочных эффектов и улучшения сна. Последнее – за счет снотворного действия М [7]. Нитраты, b-адреноблокаторы, мочегонные, антиагреганты. М значительно усиливает их антиангинальное и анти-ишемическое действие. Улучшается состояние больных, снижается частота эпизодов депрессии, нормализуется ЭКГ. Он улучшает сократимость левого желудочка за счет ингибирования реакций ПОЛ и повышения антиоксидантного статуса миокарда [7, 10]. Лекарственные средства, регулирующие функции ЖКТ Омепразол, ранитидин. У больных с кислотно-пептическими заболеваниями, получавших омепразол и ранитидин, дополнительное назначение М сопровождалось снижением количества свободных радикалов и активности пероксидазы в эпителиоцитах желудка, а также увеличением активности СОД. Это позволяет снижать дозы омепразола и ранитидина при сохранении эффективности [15,17]. Седативные и транквилизаторы. Их иногда используют при синдроме раздражённой кишки. При комбинации с М усиливается лечебное действие: быстрее нормализуется стул и психический статус, купируется боль, улучшается сон и качество жизни [3]. Лекарственные средства, регулирующие функции системы крови Железосодержащие лекарственные средства и эпоэтин-альфа. Их назначение при анемии приводит к развитию окислительного стресса (повышается содержание малонового диальдегида, снижается уровень ГSH и активность каталазы). М оказывает дозозависимое нормализующее действие [42, 43, 53]. Лекарственные средства, регулирующие минеральный гомеостаз кости Алендронат. Длительный пероральный прием алендроната провоцирует развитие окислительного стресса: активируются реакции ПОЛ и активность миелопероксидазы (МП); снижается антиоксидантный статус, особенно содержание ГSH. Это приводит к повреждению клеток желудка. Антиоксидант М оказывает цитопротекторное действие [94]. Лекарственные средства, регулирующие функции эндокринной системы Глюкокортикоиды. М усиливает лечебное действие преднизолона у больных саркоидозом: уменьшаются размеры лимфатических узлов и повреждение тканей [22, 75]. Эстрогены. Их комбинация с М оказывает более выраженное лечебное действие, чем монотерапия, у женщин с симптомами климакса (улучшается настроение, повышается работоспособность) [4]. Анальгетики-антипиретики и противовоспалительные лекарственные средства Парацетамол. В развитии его нефро- и гепатотоксичности основную роль играют свободные радикалы кислорода. Введение крысам М (внутрибрюшинно, 10 мг/кг, однократно, через 20 минут после парацетамола) оказывает антитоксическое действие. М снижает уровень мочевины и креатинина крови, малонового диальдегида, повышает уровень ГSH, глутатионпероксидазы, каталазы и СОД в почках и печени [47, 95]. Кислота ацетилсалициловая, пироксикам, индометацин. Введение М крысам (внутрибрюшинно, 10 – 60 мг/кг, однократно), получавшим вышеуказанные НПВС, приводит к снижению повышенного уровня гидроксил-радикала, интенсивности реакций перикислого окисления липидов (ПОЛ) и белков, активности миелопероксидазы, желудочной пероксидазы. Кроме того, он способствует нормализации сниженной активности СОД в клетках желудка и содержания в них ГSH. При этом ингибируется активность каталазы и циклооксигеназы. В конечном итоге уменьшается язвообразование в ЖКТ [16, 59, 71, 95]. Циклоспорин. Вызывает нефропатию и кардиомиопатию. В их развитии доминирующую роль играет окислительный стресс. М (0,5 и 1 мг/кг в день) пред-отвращает развитие органотоксичности. Это подтверждается гистологическими исследованиями почек и миокарда [50, 57, 65, 82, 90]. Химиотерапевтические лекарственные средства Противомикробные Изониазид.Комбинированное применение изониазида с М у больных туберкулезом легких оказалось более эффективным, чем монотерапия изониазидом [110]. Противоопухолевые Доксорубицин и даунорубицин. Введение крысам М (внутрибрюшинно; 6, 10, 20, 50 мг/кг, 1 раз в день, 15 дней) до и после цитостатиков приводит к снижению интенсивности реакций ПОЛ в сердце и почках. Улучшается функция сердца, предотвращается развитие нефропатии [30, 64, 92, 112, 113]. Цисплатин. М (внутрибрюшинно, 10 мг/кг) обладает нефрозащитным действием у мышей. Наиболее выраженный эффект развивался при введении М, начиная за 1 неделю до, заканчивая через 1 неделю после последнего введения цисплатин [12, 96]. Блеомицин. Свободные радикалы кислорода играют доминирующую роль в развитии блеомицин-индуцированного пневмофиброза у крыс. Антиоксидант М (внутрибрюшинно, 10 мг/кг) оказывает пневмозащитное действие [14, 84, 115]. Циклофосфамид. В патогенезе вызываемого циклофосфамидом геморрагического цистита ключевую роль играют цитокины и окислительный стресс. Это приводит к некрозу клеток слизистой оболочки мочевого пузыря, а также патологическим изменениям в лёгких, почках и яичках. М оказывает цитопротекторное действие [60, 103]. Цитарабин. Вызываемая им миелотоксичность устраняется М. Это используется для профилактики развития этого потенциально смертельного побочного действия цитарабина[13]. Эпирубицин. Вызывает тромбоцитопению и миопатию. Их проявления ослабляются М [37, 56]. Интерлейкин-2. Химиотерапия рака интерлейкином-2 часто ассоциируется с развитием тромбоцитопении. Назначение М сопровождается ослаблением макрофаг-опосредованного апоптоза тромбоцитов и повышением синтеза интерлейкина-3 [21]. При комбинированном применении интерлейкина-2 с М повышается процент трехлетней выживаемости раковых больных. Аналогичные результаты получены в опытах на крысах [25]. Этопозид, митоксантрон, 5-фторурацил, гемцитабин, паклитаксел. М снижает степень выраженности побочных эффектов этих цитостатиков и усиливает их эффективность [54, 55, 107]. Антитоксические свойства мелатонина Азиридин (этиленимин). Нейротоксическое действие азиридина у крыс (по-вреждение холинергических нейронов основания переднего мозга) в значительной степени ослабляется М. Это проявляется как в уменьшении числа поврежденных нейронов, так и в улучшении пространственной ориентации животных [6]. Цистеин. М подавляет ПОЛ, вызванное цистеином [114]. Мышьяк. М предотвращает развитие мышьяковой нейропатии [52]. Свинец. Назначение крысам, подвергнутым интоксикации свинцом, М сопровождается снижением интенсивности реакций ПОЛ, увеличением содержания ГSH, активности СОД, а также ослаблением развития поражения ЦНС, печени и почек [31]. Фтор. Интоксикация крыс фтором сопровождается снижением активности фосфатаз, сукцинатдегидрогеназы, а также повышением содержания креатинина и мочевины в плазме. М (10 мг/кг) обладает нормализующим действием [81]. Уран. Попытка удачного применения М при уран-индуцированной нефропатии базируется на важной роли свободных радикалов в развитии поражения почек и полезном антиоксидантном действии М [19]. Кадмий. М тормозит активизированное кадмием ПОЛ, что сопровождается ослаблением симптомов отравления [51, 77]. Медь, алюминий. Интоксикация медью и алюминием у крыс проявляется снижением активности СОД и глутатионпероксидазы, гибелью нейронов гиппокампа и коры больших полушарий головного мозга. Введение М сопровождается активацией СОД и глутатионпероксидазы, а также ослаблением проявлений нейротоксичности [73, 119]. Хинолиновая кислота. Нейротоксин. Повышает активность глутатионредуктазы и каталазы, снижает уровень супероксиддисмутазы, вызывает некроз нейронов. М препятствует развитию этих эффектов [98, 104, 106]. Четыреххлористый углерод.М (внутрибрюшинно; 10, 50, 100 мг/кг) снижает интенсивность реакций ПОЛ и увеличивает содержание глутатиона в печени крыс, что приводит к ослаблению проявлений гепатотоксичности ССl4 [70]. В настоящее время основное применение мелатонина (хроническая малосонница, зимняя депрессия, для улучшения адаптации при смене часовых поясов и работе в ночное время) связано с его способностью регулировать циркадные ритмы. Вышеприведенные литературные данные являются убедительным доказательством важной роли М в качестве сильнодействующего антиоксиданта. Представляется целесообразным его широкое применение при патологических состояниях органов и систем организма, в основе которых лежат свободнорадикальные цитотоксические механизмы. Кроме того, этот гормон может с успехом применяться как компонент комбинированной терапии с лекарственными средствами, активирующими цитотоксические процессы ПОЛ. Борисёнок О.А., к.м.н. Бушма К.М. "Медицинские новости" – 2011. – №1. – С. 26–29. |
|
Мелатонин
ПЛАН
I. Вступление. Обоснование актуальности темы……………………….3
II. Введение. История развития и современное состояние изучения данного
гормона. Цели изучения проблемы………………………….-
III.
1. Эмбриогенез………………………………………………………….4
2. Строение эпифиза. …………………………………………………..-
3. Физиология…………………………………………………………...-
3.1. Синтез и метаболизм мелатонина………………………………... -
3.2. Регуляция синтеза мелатонина. …………………………………..6
3.3. Мелатонин в организме. …………………………………………. -
3.4. Ритм секреции мелатонина. ……………………………………… -
3.5. Эпифиз и эндокринная система. ………………………………….7
3.5.1. Влияние эпифиза на репродуктивную функцию………….. -
3.5.2. Влияние эпифиза на функции гипофиза……………………8
3.5.3. Влияние эпифиза на функции щитовидной железы……...10
3.5.4. Влияние эпифиза на функции надпочечников…………….. -
3.5.5. Влияние эпифиза на функции околощитовидных желез...11
3.6. Эпифиз и психика……..……………………………………………-
3.7. Эпифиз и канцерогенез…….…………………………………….12
IV. Выводы…………………………………………………………………13
V. Заключение………………………………………………………………-
VI. Иллюстрации.………………………………………………………….15
VII. Список литературы.…………………………………………………...17
I. Вступление. Обоснование актуальности темы.
Эпифиз – орган, известный свыше двух тысячелетий. Однако функция его
долгое время оставалась непонятной. Было не ясно, производит ли он вообще
какие-либо биологически активные вещества или является просто рудиментом
«третьего глаза». Долгое время оставалось неясным, можно ли считать
щитовидную железу эндокринной в полном смысле этого слова.
Функция эпифиза у многих животных различных классов различается. У низших
позвоночных орган прямой фоторецепции и рассматривается как «третий глаз».
У птиц и рептилий осуществляет смешанную фоторецепторную и секреторную
функции. У млекопитающих он представляет собой инкреторную железу.
Наряду с мелатонином эпифиз продуцирует и другие биологически активные
соединения (индолы и пептиды). И все же большинство нейроэндокринных
функций, свойственных эпифизу, медиирует мелатонин. Физиологическая
значимость немелатониновых продуктов пока изучена недостаточно.
II. Введение. История развития и современное состояние изучения данного
гормона. Цели изучения проблемы.
Эпифиз человека очень мал, его величина варьируется от 50 до 200 мг, но
кровоток в нём чрезвычайно интенсивен, что косвенно свидетельствует о
важной роли его в организме. Открытие дерматологом А. Лернером в 1958 г.
эпифизарного гормона – мелатонина, названного так потому, что он вызывает
скопление меланиновых зёрен вокруг ядер меланоцитов, в результате чего
происходит посветление кожи некоторых земноводных. Это открытие и
последующие экспериментальные исследования дали достаточно оснований для
признания того, что эпифиз действительно железа внутренней секреции и её
секрет – мелатонин. За последние десятилетия, после появления
чувствительного специфического теста для определения мелатонина, об этом
органе накоплено много информации, подчас противоречивой.
При изучении данной проблемы можно выделить несколько целей:
1. Изучить синтез и метаболизм мелатонина.
2. Изучить ритм секреции мелатонина и причины сдвига ритма секреции
мелатонина.
3. Изучить влияние эпифиза и его гормона на работу желёз внутренней
секреции.
4. Выявить связь между уровнем мелатонина и психическими заболеваниями.
5. Выявить роль эпифиза в противоопухолевой резистентности организма.
III.
1. Эмбриогенез.
Развивается шишковидная железа в виде эпителиального дивертикула верхней
части межуточного мозга, позади сосудистого сплетения, на втором месяце
эмбриональной жизни. В дальнейшем стенки дивертикула утолщаются и из
эпендимальной выстилки образуются две доли – в начале передняя, затем
задняя. Между долями прорастают сосуды. Постепенно междолевая бухта
суживается (от неё остаётся только recessus pinealis), доли сближаются и
сливаются в единый орган. Паренхима передней доли образуется из клеток
передней выстилки эпифизарной бухты, задней – из секреторной эпендимы
задней стенки бухты.