
- •2 Курса фармацевтического факультета
- •Доцент н.В. Ленчик
- •Оглавление:
- •Раздел I . Теоретические основы титриметрического анализа……………………………4
- •Раздел I Теоретические основы титриметрического анализа
- •Основные понятия титриметрического анализа.
- •Концентрация – величина, выражающая относительное содержание данного компонента в растворе.
- •2. Условные обозначения.
- •3.1 Способы выражения концентрации
- •5. Анализ жидкого образца.
- •6. Определение среднего значения результатов анализа.
- •7. Способы приготовления стандартных растворов.
- •8. Запись результатов измерений и вычислений в титриметрическом анализе.
- •Раздел II Задания для самостоятельной работы
- •Тема 1: Гравиметрия
- •Задание № 1
- •Задание № 2
- •Задание № 3
- •Задание № 4
- •Задание № 5
- •Задание № 6
- •Задание № 7
- •Задание № 8
- •Задание № 9
- •Задание № 10
- •Задание № 11
- •Задание № 12
- •Тема 2: Протолитометрия. Приготовление и стандартизация титрованных растворов.
- •Задание 14
- •Задание 18
- •Задание 20
- •Тема 3: Протолитометрия. Анализ жидких образцов
- •2. Решите задачу.
- •Задание 32
- •2.Решите задачу.
- •2.Решите задачу.
- •2. Решите задачу. Задание 35
- •2.Решите задачу.
- •Тема 4: Протолитометрия. Анализ твердых образцов
- •Тема 5: Перманганатометрия Задание 49
- •Задание 50
- •Задание 51
- •Задание 52
- •Задание 53
- •Задание 54
- •Задание 55
- •Задание 56
- •Задание 57
- •Задание 58
- •Задание 59
- •Задание 60
- •Тема 6: Йодометрия. Задание 61
- •Задание 62.
- •Задание 64
- •Тема 7: Броматометрия. Задание 73
- •3. Обоснуйте возможность использования броматометрии для количественного определения Al2(so4)3 в образце.
- •Задание 74
- •3. Обоснуйте возможность использования броматометрии для количественного определения FeSo4 в образце FeSo4 7н2о.
- •Задание 75
- •3. Обоснуйте возможность использования дихроматометрии для количественного определения FeSo4 в образце.
- •3. Обоснуйте возможность использования броматометрии для количественного определения NaAsO2 в образце.
- •3. Обоснуйте возможность использования цериментрии для количественного определения FeSo4 в образце.
- •3. Обоснуйте возможность использования дихроматометрии для количественного определения ВаСl2 в образце.
- •3. Обоснуйте возможность использования броматометрии для количественного определения NaAsO2 в образце.
- •3. Обоснуйте возможность использования цериментрии для количественного определения Na2c2o4 в образце.
- •3. Обоснуйте возможность использования броматометрии для количественного определения MgSo4 в образце MgSo4 7 н2о.
- •3. Обоснуйте возможность использования йодатометрии для количественного определения SbCl3.
- •3. Обоснуйте возможность использования дихроматометрии для количественного определения FeSo4.
- •3. Обоснуйте возможность использования броматометрии 3. Обоснуйте возможность использования дихроматометрии для количественного определения FeSo4.
- •Тема 8: Нитритометрия Задание 85
- •3. Решите задачу.
- •3. Решите задачу.
- •1.Для определения ароматических аминов необходимо приготовить 2 дм3 0,1м раствора нитрита натрия.
- •Тема 9: Седиметрия
- •Решите задачу.
- •Задание 99
- •4. Решите задачу.
- •Задание 102
- •Задание 108
- •Тема 10: Комплексонометрия
- •4. Решите задачу. Задание 110
- •Решите задачу.
- •Решите задачу. Задание 112
- •Решите задачу.
- •Решите задачу. Задание 114
- •Решите задачу. Задание 115
- •4. Решите задачу. Задание 116
- •4. Решите задачу. Задание 117
- •Решите задачу. Задание 118
- •Решите задачу.
- •Решите задачу. Задание 120
- •Решите задачу.
- •Тема 11: Задачи по титриметрическому анализу Задачи по теме «Протолитометрия».
- •Задачи по теме «Перманганатометрия».
- •Задачи по теме «Йодометрия»
- •Задачи по теме «Броматометрия»
- •Задачи по теме «Нитритометрия»
- •Задачи по теме «Цериметрия»
- •Задачи по теме «Седиметрия»
- •Задачи по теме: «Комплексонометрия»
- •Тема 12: Определение протолитов в неводных средах.
2. Условные обозначения.
А – определяемое вещество;
В – титрант;
С – любое вещество;
ПСВ – первичное стандартное вещество;
ВСВ – вторичное стандартное вещество;
М.м. – молярная масса (масса 1 моль вещества в г.)
М(1/Z A) – молярная масса эквивалента (г/моль);
n – число молей вещества;
nэ – число молей эквивалента вещества;
f – фактор эквивалентности;
z –число эквивалентности;
m – масса вещества, г.
m – масса аналитической навески, г.
q – массовое содержание вещества в пробе, г.
mР – масса раствора, г.
V – объем раствора, см3
VA – объем раствора определяемого вещества, см3;
VB – объем стандартного раствора, см3;
VTB – теоретический (расчетный) объем, см3;
Vaл – аликвотный объем раствора, см3;
VB – средний объем стандартного раствора, затраченного на титрование аликвотных объемов раствора анализируемого образца;
W – вместимость мерной колбы, см3;
- плотность раствора, г/см3;
CM – молярная концентрация, моль/дм3;
CH – молярная концентрация эквивалента (нормальная), моль/дм3;
T – титр раствора, г/см3;
TB – титр стандартного раствора, г/см3;
TB/A – титр стандартного раствора В по определяемому веществу А, г/см3;
K – поправочный коэффициент;
% - массовая доля, % (массовая процентная концентрация);
’% -массо–объемная доля, %(массо – объемная концентрация)
ПРИМЕЧАНИЕ: СТМ, СТН, ТТВ, ТТВ/А - теоретическое значение
концентрации раствора
СМ, СН, ТВ, ТВ/А - практическое значение
![]() концентрации
раствора
концентрации
раствора
mТ – масса навески теоретическая (расчетная)
m – масса навески практическая
3. РАСЧЕТЫ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ.
Расчеты в аналитической химии базируются на законах сохранения массы веществ, постоянства состава и эквивалентах.
Молярная масса эквивалента вещества:
![]()
![]()
![]()
где
![]() ,
,
![]()
3.1 Способы выражения концентрации
3.1.1. Молярная концентрация раствора:
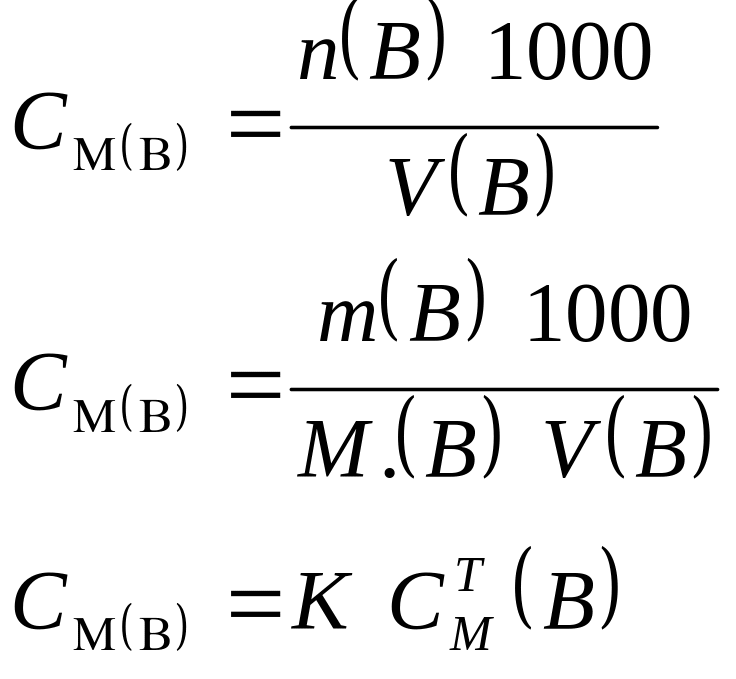
Форма записи: а) СМ (Н2SО4) = 0,1 моль/дм3
б) 0,1 М Н2SО4.
3.1.2. Молярная концентрация эквивалента (нормальная):
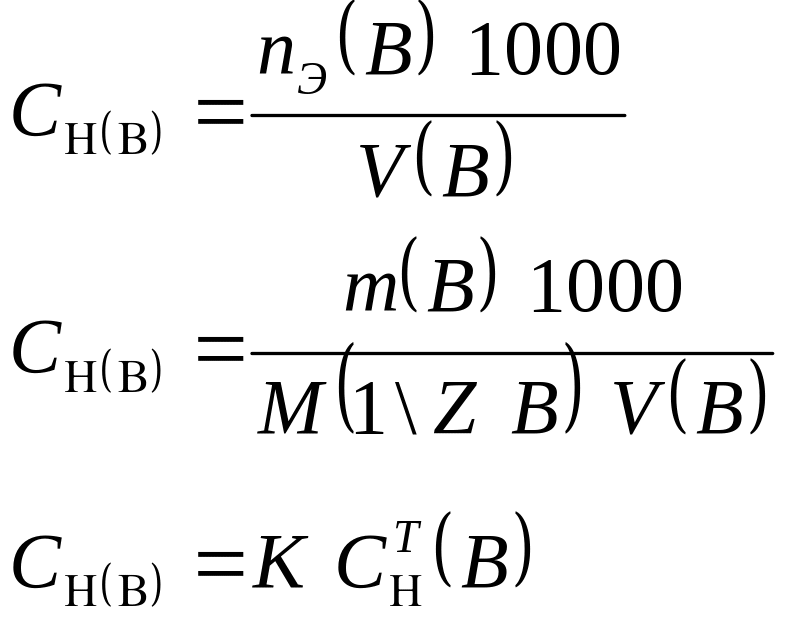
Форма записи: а) СН (КМnО4) = 0,1 моль/дм3
б) С (1/5 КМnО4) = 0,1 моль/дм3
в) 0,1 н КМnО4.
3.1.3. Плотность раствора.
![]()
3.1.4. Титр:
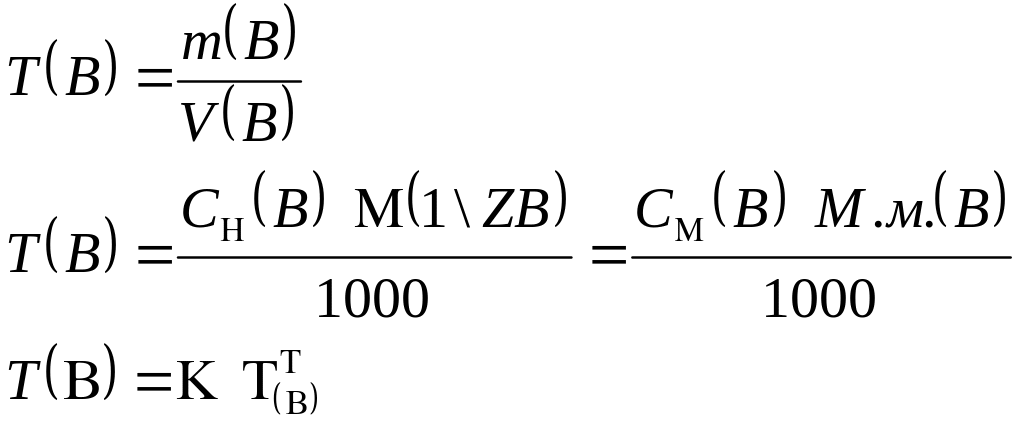
Форма записи: ТНСI = 0,003646 г/см3.
3.1.5. Титр титранта по определяемому веществу (титр соответствия):
 СВVВ
СВVВ
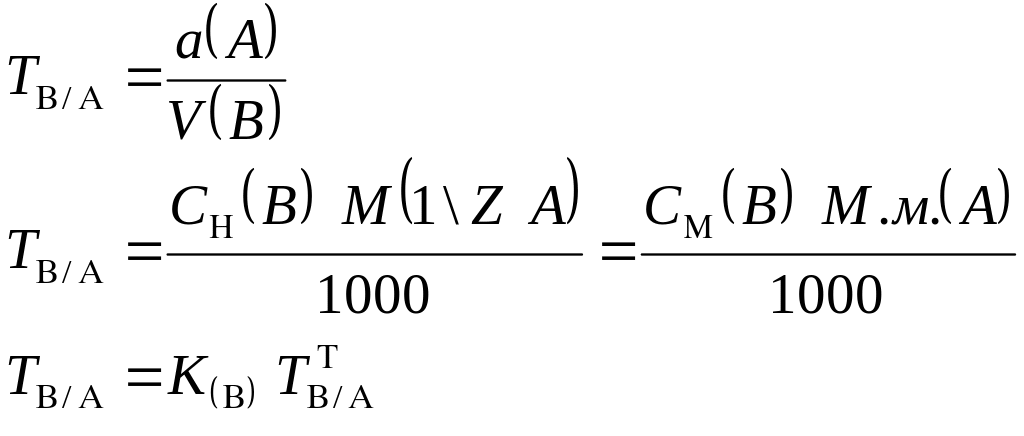
m(А)г.
Примеры:
![]() = 0,01907 г/см3
= 0,01907 г/см3
![]() = 0,003152 г/см3.
= 0,003152 г/см3.
Физический смысл титра по определяемому веществу:
титр соответствия хлороводородной кислоты по тетраборату натрия показывает, что 0,01907 г Na2B4O7 ∙10H2O взаимодействует с 1,00 см3 раствора хлороводородной кислоты, нормальная концентрация которой составляет 0,1000 моль/дм3:
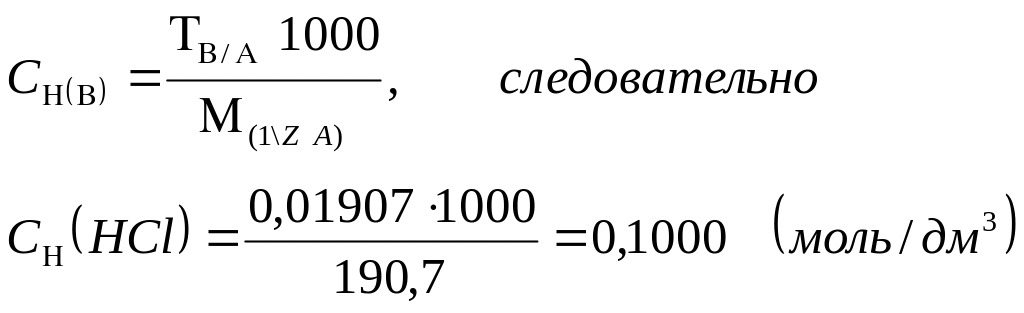
Или, титр соответствия перманганата калия по щавелевой кислоте показывает, что 0,003151 г. H2C4O4 ∙2H2O взаимодействует с 1,00 см3 раствора перманганата калия, нормальная концентрация которого составляет 0,0500 моль/дм3:
![]()
3.1.6. Поправочный коэффициент.
![]()
3.1.7. Массовая доля вещества (массовая процентная концентрация):
![]()
3.1.8. Массо - объемная доля вещества (массо - объемная концентрация):
![]()
4. СПОСОБЫ И ПРИЕМЫ ТИТРОВАНИЯ. РАСЧЕТ МАССЫ НАВЕСКИ АНАЛИЗИРУЕМОГО ОБРАЗЦА И РЕЗУЛЬТАТОВ АНАЛИЗА.
В соответствии с законом эквивалентов вещества взаимодействуют между собой в эквивалентных количествах.
4.1. В титриметрическом анализе применяют способы прямого, косвенного (титрование заместителя) и обратного титрования.
4.1.1. В прямом титровании (титрованию по остатку) определяемое вещество А непосредственно реагирует с титрантом В.
А + В С
+ В С
Разновидностью прямого титрования является реверсивное титрование, при котором аликвотный объем стандартного раствора титруют раствором анализируемого вещества из бюретки.

VB , CB VА
mА или Vал Vал B, CB
прямое реверсивное
В случае, если непосредственное взаимодействие между определяемым веществом и титрантом не удовлетворяет всем требованиям, предъявляемым к химическим реакциям титриметрического анализа, используют косвенное или обратное титрование.
4.1.2. В косвенном (заместительном) титровании титрант В взаимодействует в эквивалентных количествах с заместителем З, образовавшемся в эквивалентном определяемому веществу А количестве после добавления к нему вспомогательного реактива Р.
А Х
+ Р З
Х
+ Р З
З + В С
4.1.3. В обратном титровании (титровании по остатку) к определяемому веществу А добавляют фиксированное избыточное количество стандартного раствора В1, остаток которого оттитровывают стандартным раствором В2.
А Х + В1 ИЗБ. С
В1 ОСТ + В2 Д

 VB , CB В2
VB , CB В2


АХ + Р З АХ + B1 ИЗБ
заместительное обратное (по остатку)
4.2. При этом во всех способах титрования используют два приема:
прием титрования отдельной навески анализируемого образца;
прием пипетирования.
4.2.1. В первом случае точная навеска анализируемого образца растворяется в произвольном объеме растворителя и целиком оттитровывается стандартным раствором. При этом массу теоретической навески рассчитывают, исходя из того, чтобы на её титрование было затрачено приблизительно 15-20 см3 стандартного раствора (VT), т. е. объем, не превышающий объема бюретки. Массу теоретической навески анализируемого образца в прямом и заместительном титровании рассчитывают по формуле:
![]()
Теоретический объем раствора анализируемого вещества в приеме титрования отдельной навески рассчитывают по формуле:
![]() ,
,
где % - массовая доля в % вещества А в анализируемом растворе;
- плотность анализируемого раствора, г/см3.
 СВ VВ
СВ VВ
m АХ или Vaл АХ
4.2.2. В приеме пипетирования из точной навески анализируемого образца готовят в мерной колбе раствор с концентрацией, примерно равной концентрации титранта. На титрование берут с помощью пипетки Мора аликвотный объем приготовленного раствора переносят в колбу для титрования и титруют её стандартным раствором.
 W
СВ VВ
W
СВ VВ
 m
АХ или
m
АХ или
Vaл АХ Vaл АХ
В приеме пипетирования массу теоретической навески анализируемого образца рассчитывают по формуле:
![]()
Теоретический объем раствора анализируемого вещества в приеме пипетирования рассчитывают по формуле:
![]()
В приеме титрования отдельной навески по способу обратного титрования массу теоретической навески анализируемого образца и теоретический объем раствора анализируемого образца рассчитывают по формулам:
![]()
![]() ,
,
г де
V1
и V2
– теоретические
де
V1
и V2
– теоретические
объемы первого и второго титрантов. В2 С2V2
Например: V1 =25, V2 = 15
или V1 =50, V2 = 15 С1V1
m(Vал АХ) + В1ИЗБ.
В таблице 1 приведены формулы, используемые для расчета массового содержания (q) определяемого компонента А в анализируемом образце и формулы расчета навески образца в приеме титрования отдельной навеки и приеме пипетирования при различном способе выражения концентрации титранта.
Массовую долю компонента А (%) при взятии точной навески образца анализируемого различными способами и приемами, находят по формуле:
![]() ,
,
где m – навеска образца, г.
