- •А.В. Мышлявцев, м.Д. Мышлявцева математическое моделирование в естественных науках
- •Введение
- •Глава 1. Основные понятия и примеры математических моделей
- •1.1. Примеры эмпирических моделей
- •Результаты победителей олимпийских игр в беге на 200 м,
- •Результаты победителей олимпийских игр в беге на 200 м,
- •1.2. Разведение семги
- •1.3. «Ядерная зима»
- •«Волны-убийцы»
- •«Ядерная зима»
- •1.4. Некоторые подходы при моделировании сложных систем и явлений
- •Иерархическая цепочка моделей
- •Многомасштабное моделирование
- •Глава 2. Математическое моделирование в физике
- •2.1. Траектория всплытия подводной лодки
- •2.2. Диффузия
- •2.3. Метод молекулярной динамики
- •Метод Верле и метод «прыжка лягушки»
- •Классическая молекулярная динамика
- •Применение метода молекулярной динамики при моделировании реальных систем
- •2.4. Модель решеточного газа
- •Применение метода трансфер-матрицы при исследовании одномерной мрг
- •Эквивалентность мрг и модели Изинга
- •Применение метода Монте-Карло при исследовании двумерной мрг
- •Глава 3. Математическое моделирование в химии и химической технологии
- •3.1. Уравнения состояния реальных газов
- •Нелинейные уравнения
- •Метод бисекций
- •Метод Ньютона
- •Определение молярного объема реального газа
- •3.2. Вычисление равновесных концентраций
- •Системы нелинейных уравнений
- •3.3. Определение состава газа методом масс-спектроскопии смеси после бомбардировки медленными электронами
- •3.4. Определение числа независимых стехиометрических уравнений
- •3.5. Как плод получает глюкозу от своей матери?
- •Глава 4. Математическое моделирование в биологии
- •4.1. Примеры математических моделей популяционной биологии
- •Уравнение Ферхюльста (логистическое уравнение)
- •Популяционная модель с дискретным временем
- •Модели взаимодействующих видов
- •Модель Вольтерра и ее обобщения
- •4.2. Модель работы нейрона
- •4.3. Третичная структура белка
- •Список литературы
- •Математическое моделирование в естественных науках
2.3. Метод молекулярной динамики
В
настоящее время классическая
молекулярная динамика превратилась
в один из самых мощных инструментов
изучения молекулярных систем. Сущность
этого подхода заключается в моделировании
системы
![]() материальных точек массой
материальных точек массой
![]() ,
,
![]() ,
взаимодействующих между собой.
,
взаимодействующих между собой.
Взаимодействие
описывается при помощи потенциальной
функции
![]() ,
где
,
где
![]() – радиус-векторы материальных точек.
Моделирование сводится к численному
решению классических уравнений движения:
– радиус-векторы материальных точек.
Моделирование сводится к численному
решению классических уравнений движения:
 (2.23)
(2.23)
где
![]() ,
,
![]() ,
,
![]() – координаты
– координаты
![]() -й
частицы по осям
-й
частицы по осям
![]() ,
соответственно;
,
соответственно;
![]() – проекции силы, действующей на
-ю
частицу, на ось
,
соответственно;
– проекции силы, действующей на
-ю
частицу, на ось
,
соответственно;
![]() – время.
– время.
Затем производится усреднение вдоль траекторий, и на основе этого усреднения вычисляются необходимые термодинамические характеристики.
Основной проблемой при построении модели является выбор поля сил, т.е. потенциальной функции . В литературе можно найти большой выбор таких функций в зависимости от изучаемой системы. Мы рассмотрим только основные составляющие этих сил, которые являются общими практически для всех систем.
а) Внутримолекулярные силы
Внутримолекулярные степени свободы часто описываются в очень упрощенном виде с использованием понятия длины связи и угла между связями. Соответствующий вклад в общую потенциальную энергию можно тогда записать, используя внутренние координаты. Например, вклад в потенциальную энергию, связанный с изменением длины связи, может быть записан как
![]() (гармоническое
приближение), (2.24)
(гармоническое
приближение), (2.24)
где
![]() – расстояние между
-й
и
– расстояние между
-й
и
![]() -й
частицами, принадлежащими одной связи;
-й
частицами, принадлежащими одной связи;
![]() – равновесное расстояние между теми
же частицами;
– равновесное расстояние между теми
же частицами;
![]() – соответствующая силовая константа.
– соответствующая силовая константа.
Аналогичные выражения могут быть записаны для членов, связанных с изменением углов.
Заметим, что экспериментальное определение силовых констант и им подобных осуществляется спектроскопическими методами, которые напрямую измеряют частоты внутримолекулярных колебаний.
б) Межмолекулярные силы
Отталкивание на малых расстояниях (следствие принципа Паули) и слабое притяжение на больших расстояниях (силы Ван-дер-Ваальса) – характерная черта любой молекулярной системы. Простейшей и часто используемой моделью является парный потенциал Ленарда-Джонса
![]() ,
(2.25)
,
(2.25)
где
![]() – параметры модели;
– параметры модели;
![]() – расстояние между молекулами.
– расстояние между молекулами.
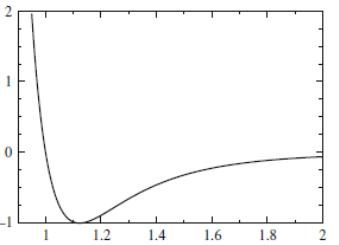
Потенциал
Ленарда-Джонса изображен на рис. 2.2.
Положение минимума определяется
параметром
![]() ,
,
![]() ,
а минимальное значение энергии –
параметром
,
а минимальное значение энергии –
параметром
![]() ,
,
![]() .
.
Распределение зарядов в молекулярных системах описывается через распределение мультиполей. Соответственно, электростатические взаимодействия описываются как взаимодействия заряд-заряд, заряд-диполь, диполь-дипольные взаимодействия и т.д. насколько это необходимо.
Если амплитуда внутримолекулярных колебаний мала, а это почти всегда выполняется для не слишком высоких температур, то колебательные и враща-
U/ε |
r/σ |
Рис. 2.2. Потенциал Ленарда-Джонса |
|
Опишем максимально упрощенную модель молекулярной системы без учета внутренних степеней свободы с полем сил Ван-дер-Ваальса. Эта модель достаточна адекватна для благородных газов, а также для разреженных газов, состоящих из неполярных небольших молекул, например, метана. Далее мы будем иметь в виду именно благородные газы. В этом случае сила, действующая на -й атом, определяется градиентом потенциала Ленарда-Джонса:
 .
(2.26)
.
(2.26)
При вычислении термодинамических характеристик Ленарда-Джонсовского газа на первом этапе необходимо решить уравнение движения (2.23) с силой, определяемой (2.26) для достаточно большого количества атомов. Решение уравнений движения для большого количества частиц обычно осуществляется либо при помощи метода Верле (Verlet), либо метода «прыжка лягушки» (leapfrog method).
Дадим краткое описание этих методов.