
Эти два класса органических веществ — альдегиды и кетоны — характеризуются присутствием в молекуле карбонильной группы, или радикала карбонила, >С=О. В альдегидах атом углерода этого радикала связан не менее чем с одним атомом водорода, так что получается одновалентный радикал называемый также альдегидной группой. В кетонах карбонильная группа связана с двумя углеводородными радикалами и называется также кетогруппой или оксо-группой.
Гомологический ряд альдегидов и их номенклатура
Простейший альдегид, называемый муравьиным альдегидом или формальдегидом, содержит альдегидную группу, связанную с атомом водорода, и имеет строение, или сокращенно
Н—СНО. В остальных альдегидах предельного ряда место одного атома водорода занимает алкил: СnС2n+1—СНО.
Альдегиды можно также рассматривать как вещества, происшедшие от замещения в парафиновых углеводородах атома водорода на альдегидную группу, т. е. как однозамещенные производные углеводородов гомологического ряда метана. Следовательно, здесь гомология и изомерия те же, что и для других однозамещенных производных предельных углеводородов.
Названия альдегидов производятся от тривиальных названий кислот с тем же числом атомов углерода в молекуле. Так, альдегид СН3—СНО называется уксусным альдегидом или ацетальдегидом, СН3СН2—СНО — пропионовым альдегидом, СН3СН2СН2—СНО — нормальным масляным альдегидом или бутиральдегидом, (СН3)2СН—СНО — изомасляным альдегидом, альдегиды С4Н9—СНО — валериановыми альдегидами и т. д.
Гомологический ряд кетонов и их номенклатура
Простейший из кетонов имеет строение СН3—СО—СН3 и называется диметилкетоном или ацетоном. От ацетона можно произвестигомологический ряд последовательным замещением атомов водорода на метил. Таким образом, следующий гомолог ацетона — метилэтилкетонимеет строение СН3—СО—СН2—СН3. Третий гомолог может существовать в трех изомерных формах:
Альдегиды и кетоны с одинаковым числом атомов углерода в молекуле изомерны друг другу. Общая формула для гомологических рядов предельныхальдегидов и кетонов: СnН2nО.
Альдегиды и кетоны содержат в молекуле одну и ту же карбонильную группу, обусловливающую много общих типических свойств. Поэтому имеется очень много общего и в способах получения и в химических реакциях обоих этих родственных классов веществ. Присутствие в альдегидах атомаводорода, связанного с карбонильной группой, обусловливает ряд отличий этого класса веществ от кетонов.
Физические свойства. Оксосоединения не способны образовывать водородные связи, поэтому их температуры кипения значительно ниже, чем соответствующих спиртов. Температуры кипения кетонов обычно бывают несколько выше, чем изомерных им альдегидов.
В обычных условиях только формальдегид является газом. Остальные оксосоединения — жидкости или твердые вещества. Формальдегид Н2СО имеет резкий неприятный запах. Средние гомологи ряда альдегидов обладают устойчивым характерным запахом (альдегидный запах). Высшие альдегиды (С7—С16) обладают приятным запахом и широко используются в парфюмерии.
Формальдегид хорошо растворим в воде, его 40%-ный водный раствор называют формалином. Ацеталъдегид (этаналь) СНзСНО также хорошо растворим в воде.
Ацетон (пропанон, или диметилкетон) — бесцветная жидкость, хорошо растворимая в воде, спирте и эфире. Это широко используемый органический растворитель, он хорошо растворяет жиры, смолы и многие другие органические вещества.
Физические свойства
Первый член гомологического ряда предельных альдегидов НСНО - бесцветный газ, несколько последующих альдегидов - жидкости. Высшие альдегиды - твердые вещества. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Температура кипения альдегидов возрастает с увеличением молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 оС, а пропиловый спирт - при 97,8 оС. Плотность альдегдов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие - хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие - приятный запах. Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением словакетон. Например: CH3–CO–CH3 - диметилкетон (ацетон); CH3CH2CH2–CO–CH3 - метилпропилкетон. В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК). Примеры: CH3–CO–CH3 - пропанон (ацетон); CH3CH2CH2–CO–CH3 - пентанон-2; CH2=CH–CH2–CO–CH3 - пентен-4-он-2. Слово "альдегид" буквально означает "спирт, лишенный водорода" (от лат. alcohol dehydrogenatus), т. е. окисленный спирт
Химические свойства альдегидов
Для карбонильных соединений характерны реакции различных типов:
присоединение по карбонильной группе;
полимеризация;
конденсация;
восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О. Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
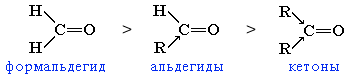
Это объясняется, главным образом, двумя факторами:
углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
I. Реакции присоединения
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH
первичный спирт

2. Присоединение циановодородной кислоты (синильной):
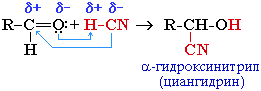
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O -> R-CH(COOH)OH + NH3
CH3-CH=O + H-CN → CH3-CH(CN)-OH
CH3-CH(CN)-OH циангидрин –яд! в ядрах косточек вишен, слив
3. Со спиртами – получают полуацетали и ацетали:
OH OR’
│ │
R-C-OR’ R- C -OR’
│ │
H H
полуацеталь ацеталь

Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:

СH3-CH=O + 2CH3OH H+↔ CH3 –CH-OCH3 + H2O
│
OCH3
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами.
4. Присоединение воды:
H
│
HCH=O + H2O ↔ H –C - OH (гидратная форма альдегида – формальдегида)
│
OH
5. Присоединение реактива Гриньяра
(используется для получения первичных спиртов, кроме метанола):
R-X(р-р в диэтиловом эфире) + Mg стружка → R-Mg-X (реактив Гриньяра) + Q
Здесь R – алкильный или арильный радикал; Х – это галоген.
HCH=O + CH3-Mg-Cl → CH3-CH2-O-Mg-Cl (присоединение)
CH3-CH2-O-Mg-Cl + H2O → CH3-CH2-OH + Mg(OH)Cl (гидролиз)
6. Взаимодействие с аммиаком
II. Реакции окисления
1. Рекция серебряного зеркала – качественная реакция на альдегидную группу:
R-CH=O + 2[Ag(NH3)2]OH → R-C=O +2Ag↓ +3NH3 + H2O
│
ONH4
(соль аммония)
или упрощённо
R-CH=O + Ag2O NH3→ R-COOH + 2 Ag↓
карбоновая кислота
2. Окисление гидроксидом меди(II):
R-CH=O + 2Сu(OH)2 t → R-COOH + Cu2O +2H2O
голубой красный
