
- •Титриметрические методы анализа
- •1.1. Сущность метода и его достоинства
- •Правила титрования
- •Ошибки анализа
- •1.2. Методы титрования
- •Способы проведения титрования
- •Способы выражения концентрации растворов в титриметрическом анализе
- •Растворы в титриметрическом анализе. Приготовление исходных или титрованных растворов
- •Кислотно-основное титрование
Растворы в титриметрическом анализе. Приготовление исходных или титрованных растворов
В титриметрическом методе анализа используют растворы с точно известной концентрацией. Такие растворы называют стандартными. Различают первичные и вторичные стандарты.
Первичным стандартом называют стандартным раствор, приготовленный по точной навеске. Реагент для приготовления первичного стандарта должен удовлетворять ряду требований:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть устойчивым при хранении;
4) должно иметь возможно большую молярную массу эквивалента.
Первичные стандарты используют как для обычных титриметрических определений, так и для установления точной концентрации растворов вторичных стандартов.
Вторичным стандартом называют стандартный раствор, концентрация которого установлены по первичному стандарту.
Процесс определения точной концентрации вторичного стандартного раствора титрованием по первичному стандартному раствору называется стандартизацией раствора.
Для приготовления раствора заданной концентрации (первичного стандарта или титранта) взвешивают на аналитических весах на часовом стекле с точностью до 0,0001 г необходимые массы (отмеряют необходимые объемы) чистых компонентов раствора, переносят количественно в чистую мерную колбу, растворяют и доводят до метки растворителем. Для приготовления титрантов и растворов стандартов применяют также специальные стандарт-титры – фиксаналы. Фиксанал – раствор или сухое вещество, помещенный в герметичную ампулу заводского производства, содержащий строго определенное (обычно 0,1 моль) количество химического соединения.
Растворение содержимого фиксанала в мерной колбе позволят сразу получать титрованный раствор, это значительно сокращает время на приготовление титрованного раствора.
Титриметрические определения могут быть выполнены двумя способами:
способом отдельных навесок, при котором берут несколько (2-3) близких по величине навесок анализируемого (или стандартного) вещества, помещают каждую в отдельную колбу для титрования, растворяют в произвольном объеме дистиллированной воды и полученные растворы титруют;
способом пепетирования – навеску анализируемого (или стандартного) вещества помещают в мерную колбу, растворяют в дистиллированной воде, доводят раствор до метки и тщательно перемешивают, закрыв колбу пробкой; затем отбирают пипеткой аликвотную часть приготовленного раствора и титруют.
Способ отдельных навесок характеризуется более высокой точностью, так как измерение объема производится только один раз по бюретке, но многократные этапы взвешивания увеличивают длительность анализа. Способ пепетирования, несмотря на несколько меньшую точность (трехкратное измерение объема, наличие этапа разбавления и проч.) характеризуется быстротой и удобством определения.
Кислотно-основное титрование
Кислотно-основное титрование – это метод определения кислот, оснований, солей, основанный на реакции взаимодействия между протолитами – кислотой НА и основанием В:
НА + В = А- + НВ+
В водных растворах – это реакция нейтрализации:
Н3О+ + ОН- = 2Н2О
Поэтому метод кислотно-основного титрования также называют методом нейтрализации.
Реакция кислотно-основного взаимодействия
- протекает быстро,
- практически необратима,
- протекает строго стехиометрично,
т.е. удовлетворяет требованиям, предъявляемым к реакциям, применяемым в титриметрическом анализе.
Титрантами метода являются растворы сильных кислот и оснований: HCl, H2SO4, NaOH, KOH. Эти вещества не соответствуют требованиям, предъявляемым к стандартным веществам, поэтому концентрацию титрантов устанавливают стандартизацией их растворов. В качестве первичных стандартов чаще используют гексагидрат тетрабората натрия Na2B4O7 · 10H2O, безводный карбонат натрия Na2CO3, дигидрат щавелевой кислоты H2C2O4 · 2H2O и некоторые другие. Растворы кислот и оснований, как правило, бесцветны, и реакции между ними не сопровождаются какими-то заметными внешними эффектами. Точка эквивалентности в кислотно-основном титровании определяется по изменению рН раствора. Поэтому для определения характера среды и для приблизительной оценки рН используют кислотно-основные индикаторы - органические красители, структура и окраска которых зависит от величины водородного показателя рН (табл. 2).
Таблица 2. Области перехода окраски некоторых рН-индикаторов
Индикатор |
Окраска кислотной формы |
Окраска щелочной формы |
Область перехода рН |
рТ |
Фенолфталеин |
Бесцветная |
Красная |
8,0-10,0 |
9,0 |
Лакмус |
Красная |
Синяя |
5,0-8,0 |
7,0 |
Метиловый оранжевый |
Розовая |
Желтая |
3,1-4,4 |
4,0 |
Метиловый красный |
Красная |
Желтая |
4,2-6,2 |
5,5 |
Как видно из табл.2, изменение окраски важнейших кислотно-основных индикаторов происходит внутри определенного узкого интервала значений рН растворов. Этот интервал зависит только от свойств данного индикатора, поэтому перемена окраски индикатора происходит, как правило, не строго в точке эквивалентности, а с известным отклонением от нее. То значение рН, при котором заканчивается титрование с данным индикатором, называется показателем титрования и обозначается рТ.
Таким образом, рТ – оптимальное значение рН титруемого раствора, при котором наблюдается наиболее резкое изменение окраски индикатора, свидетельствующее об окончании титрования. Величина рТ соответствует одной из промежуточных окрасок индикатора и находится внутри области перехода.
Следует учитывать, что экспериментально наблюдаемая конечная точка титрования вследствие погрешностей измерений и наблюдений отличается от истинной точки эквивалентности, соответствующей стехиометрическим соотношениям реагирующих веществ. Очевидно, что от выбора индикатора зависит индикаторная ошибка титрования, величина которой может колебаться в широких пределах в зависимости от того, какой взят индикатор и какие кислота и основание реагируют между собой. Так, в случае титрования кислоты основанием, при рТ7 (при 298К) имеет место недотитрованность, а при рТ7 – перетитрованность. Относительная систематическая погрешность кислотно-основного титрования для сильных кислот и оснований может быть рассчитана по формуле:
![]() 100% (10),
100% (10),
где
![]() ,
,
![]() и
С0 – молярные концентрации
ионов ОН, Н+
и титруемого вещества соответственно.
и
С0 – молярные концентрации
ионов ОН, Н+
и титруемого вещества соответственно.
Например,
при титровании 0,01 М раствора сильной
кислоты раствором сильного основания
в присутствии фенолфталеина (рТ=9)
![]() .
.
Титрование различных кислот и оснований должно проводиться до определенных значений рН раствора. Для правильного определения точки эквивалентности нужно выбирать индикатор, у которого значение показателя титрования (рТ) было как можно ближе к значению рН раствора в точке эквивалентности и совпадало со скачком на кривой титрования.
Процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение рН титруемого раствора в зависимости от объема добавленного титранта. Вблизи точки эквивалентности происходит резкое изменение рН раствора, называемое скачком рН.
Скачок рН зависит от концентрации тируемого раствора и титранта, температуры раствора. При титровании также необходимо учитывать силу кислот и оснований.
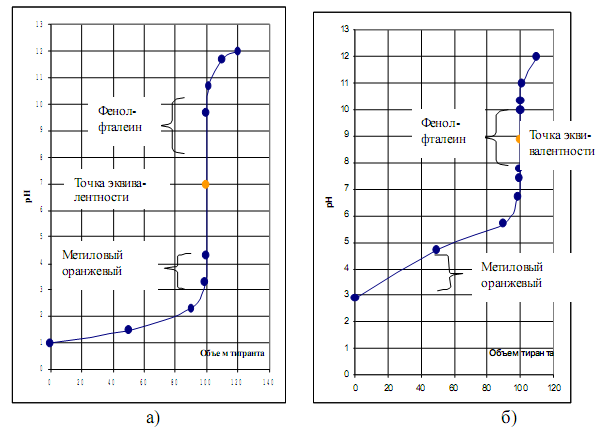
Рис. 2.1. Кривые титрования: а) сильной кислоты сильным основанием;
б) слабой кислоты сильным основанием.
При титровании сильной кислоты сильным основанием в точке эквивалентности образуется соль, которая не подвергается гидролизу, поэтому рН раствора в точке эквивалентности совпадает с рН чистой воды и равен 7 (рис 2.1а). В этом случае точка нейтральности совпадает с точкой эквивалентности. Скачок титрования сильной кислоты сильным основанием находится в пределах от 4,3 до 9,7 рН (при концентрации реагирующих веществ 0,1 моль/л). Поскольку рН в точке эквивалентности равен 7, то в качестве индикатора можно использовать лакмус (рТ лакмуса равно 7). Из графика видно, что для фиксирования точки эквивалентности в данном случае могут быть также использованы индикаторы: метиловый оранжевый (рТ = 4) и фенолфталеин (рТ = 9). При титровании интервалы перехода этих индикаторов опадают в область скачка рН на кривой титрования. Изменение окраски этих индикаторов происходит при объемах добавленной щелочи (99,9 мл и 100,1 мл), очень близких к объему, который соответствует точке эквивалентности.
При титровании слабой кислоты сильным основанием (рис. 2.1б) вид кривой титрования зависит еще и от константы диссоциации кислоты. В данном случае точка эквивалентности не совпадает с точкой нейтральности.
Точка эквивалентности смещается в сторону более высоких значений рН (в щелочную область) из-за гидролиза соли, образующейся в точке эквивалентности. Скачок титрования уменьшается (7,7 – 10,0) и будет тем меньше, чем слабее титруемая кислота. При титровании слабой кислоты сильным основанием из рассмотренных в предыдущем случае индикаторов может быть использован только фенолфталеин. Кроме того, в данном случае могут быть использованы и такие индикаторы, как феноловый красный и тимолфталеин.
При титровании слабого основания сильной кислотой в точке эквивалентности образуется соль, гидролиз которой протекает по катиону. Поэтому при титровании раствора аммиака соляной кислотой точка эквивалентности не совпадает с точкой нейтральности и смещается в кислую область (рН = 5,1). В этом случае точку эквивалентности можно определить с помощью индикаторов – метиловый оранжевый, метиловый красный или бромтимоловый синий.
При титровании слабой кислоты слабым
основанием (и, наоборот) на кривой
титрования получается маленький
скачок титрования. Точка эквивалентности
приближается к точке нейтральности.
Значение константы равновесия реакции
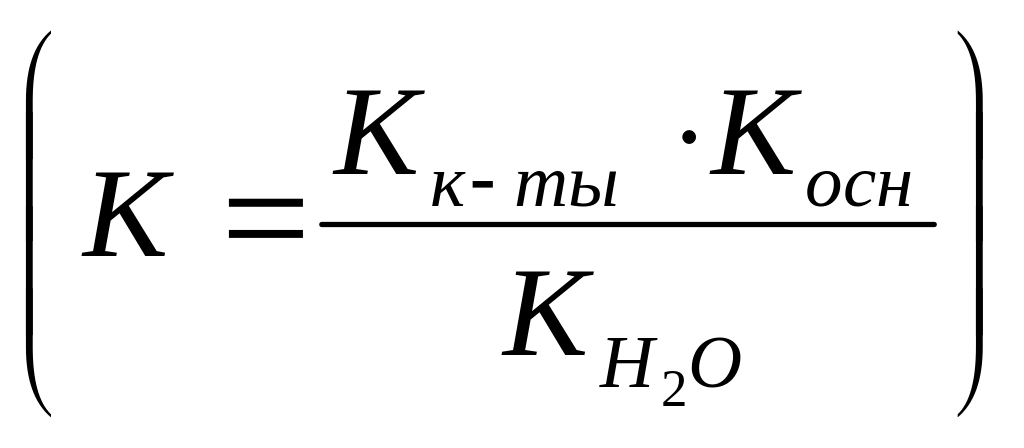 оказывается
меньше чем 108. Поэтому титрование
слабых кислот слабыми основаниями не
используют.
оказывается
меньше чем 108. Поэтому титрование
слабых кислот слабыми основаниями не
используют.
Таким образом, с помощью кривых титрования, по известному скачку титрования и интервалу перехода индикатора, можно подобрать индикатор, подходящий для данного титрования.
