
- •Конспект лекций для подготовки по направлению
- •220700 Автоматизация технологических процессов и производств
- •1. Введение
- •2.2. Горение оксида углерода(II) и водорода
- •2.4. Горение твердого углерода
- •3. Диссоциация и образование химических соединений
- •Рассмотрим вопрос на примере диссоциации оксида Ме(II) по реакции
- •В качестве примера рассмотрим влияние плавления Ме и МеО на упругость диссоциации МеО.
- •3.3. Диссоциация оксидов и сульфидов, образующих растворы
- •Из выражения (18) находим , проводим преобразования полученной зависимости с учетом закона Генри и ее анализ.
- •3.4. Механизм и кинетика диссоциации соединений
- •4.1. Окисление твердых сульфидов Термодинамика процесса
- •Кинетика окисления твердых сульфидов
- •4.2. Взаимодействие сульфидов с оксидами
- •5. Процессы восстановления оксидов металлов
- •5.1. Газовое восстановление свободных оксидов нелетучих металлов
- •5.2. Газовое восстановление оксида летучего металла
- •5.3. Газовое восстановление оксида металла из расплава
- •6. Металлургические расплавы
- •7. Потери цветных металлов со шлаками
- •7.1. Электрохимические потери
- •7.2. Механические потери цветных металлов со шлаками
- •8. Процессы, основанные на ликвации, испарении и конденсации
- •8.1. Ликвационные процессы
- •8.2. Процессы, основанные на испарении и конденсации
- •9. Выщелачивание
- •10.1. Основы экстракционных процессов
- •10.2. Основы ионообменных процессов
- •10.3. Выделение металлов из растворов в виде труднорастворимых соединений
- •10.4. Выделение металлов из водных растворов водородом.
- •10.5. Выделение металлов цементацией
- •10.6. Основы процессов кристаллизации из растворов
- •11. Электролиз водных растворов
- •Рекомендательный библиографический список
- •Содержание
10.2. Основы ионообменных процессов
Ионообменные процессы основаны на способности некоторых твердых веществ, нерастворимых в воде и называемых ионитами, при контакте с растворами электролитов обмениваться ионами того же знака, входящими в состав ионита и раствора. Ионитами являются как некоторые неорганические материалы, так и искусственные органические материалы в виде твердых полимерных переплетенных нитей.
По закону обменивающих ионов различают катиониты, аниониты и амфолиты. В гидрометаллургии в качестве ионитов используют синтетические смолы, которые выпускают в промышленности в виде гранул размером от 0,5 до 3-4 мм. Характеристики ионитов: плотность, набухаемость, насыпная масса, обменная емкость, механическая прочность, химическая устойчивость. Обменная емкость смолы выражается обычно в мг-экв/г смолы (колеблется от 3 до 10).
Процесс десорбции поглощенного на смоле иона называют элюированием. В результате элюирования поглощенных ионов из достаточно насыщенной («нагруженной») смолы получают элюаты с концентрацией металла в 100 и более раз, чем в исходных растворах.
10.3. Выделение металлов из растворов в виде труднорастворимых соединений
Разновидности труднорастворимых соединений, используемых в гидрометаллургии: гидроксиды металлов, сульфиды металлов, соли неорганических кислот, соли органических кислот.
Рассмотрим подробнее осаждение металлов из растворов в виде гидроксидов и основных солей. Реакции гидролиза с образованием таких осадков из раствора MeSO4:
![]() (56)
(56)
![]() (57)
(57)
Гидроксиды и основные соли диссоциируют в водном растворе по реакциям:
![]() (58)
(58)
![]() (59)
(59)
Основной термодинамической характеристикой равновесия между малорастворимым соединением и раствором является произведение растворимости (L), которое численно равно активности ионов. Для реакции (59):
![]() (60)
(60)
После логарифмирования выражения (60) и преобразований получим выражение для рНравн гидратообразования:
![]() (61)
(61)
Привести рН грамму (рис.8) и дать примеры ее использования в практике производства металлов.
10.4. Выделение металлов из водных растворов водородом.
Реакция восстановления катиона металла водородом:
![]() (62)
(62)
может протекать вправо если электродный потенциал водорода меньше электродного потенциала металла:
![]() .
.
Равновесная
активность (концентрация) металла в
растворе при осаждении водородом зависит
от природы металла, рН раствора и давления
водорода (![]() ).
Такие металлы как Cu, Ag, Au можно осадить
водородом даже из сильнокислых растворов.
).
Такие металлы как Cu, Ag, Au можно осадить
водородом даже из сильнокислых растворов.
10.5. Выделение металлов цементацией
Цементацией называют процесс выделения из раствора ионов одного металла другим металлом (цементатором), находящимся в свободном состоянии. Процесс описывается реакцией:
![]() (63)
(63)
Где z1+ и z2+ -заряды катионов.
Термодинамически протекание реакции (63) возможно вправо при
![]() .
.
Условие
равновесия реакции (63):
![]()
или
![]() . (64)
. (64)
После преобразований выражения (64) получим:
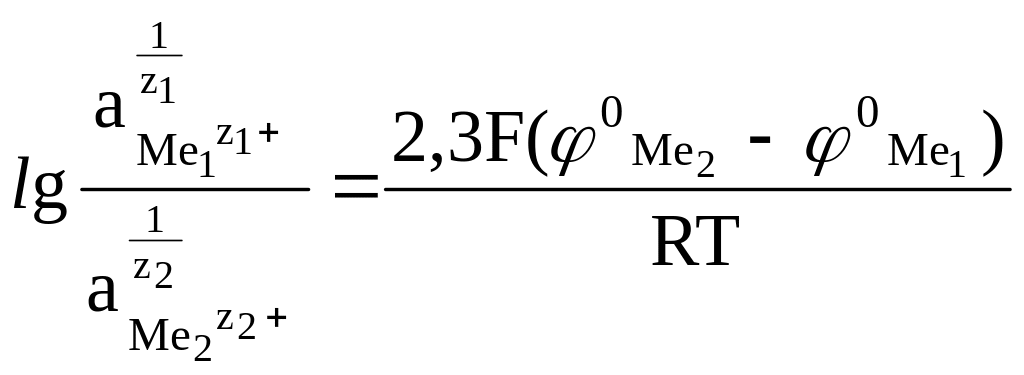 . (65)
. (65)
По выражению (65) можно рассчитать равновесные отношения активностей ионов металлов для различных пар металлов. Привести результаты таких расчетов.
Рассмотреть механизм и кинетику процесса цементации.
