
6)Расчетная часть
Составить уравнение экстракции протактиния (5) ТБФ из азтнокислого раствора (3М) при h=0, q=2.
Расчитать:
1)равновесную концентрацию протактиния в органической фазе при D=6,8 и при Х= М/л;
2)коэффициент экстракции протактиния при n=1,5;
3)степень
извлечения протактиния при
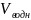 =
= ;
;
4)концентрационную константу равновесия при S=0,2 М
5)удельную радиоактивность (Бк/л) протактиния-231 в экстракте и в раввинате при заданных выше условиях экстракционного равновесия.
Решение
Уравнение экстракции:
2(C4H9O)3PO + Pa(NO3)5 → Pa(NO3)5·2(C4H9O)3PO
1)Находим равновесную концентрацию протактиния в органической фазе из формулы (1) D= → Y=D·X, известно, что D=6,8, а X= М/л
Y=D·X=
6,8·
=
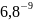 М/л
М/л
2)рассчитываем коэффициент экстракции протактиния из формулы (2), при n=1,5 и D=6,8
μ=D·n= 6,8·1,5= 10,2
3) найдем степень извлечения протактиния по формуле (3).
Из формулы (4) определяем Vo , при условии, что n=1,5 и =
Vo=
n·
=1,5·15=
22,5
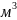
Е
=
=
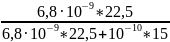 =
0,91
=
0,91
4)находим концентрационную константу равновесия из формулы (5), известно, что z = +5, так как протактиний не образует диоксокатионы, D=6,8, S=0,2 М, q=2
[А]=
Z
Cв
=
5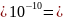

D=
K
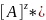
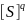
 K=
K=
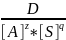 =
=
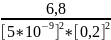 =
=
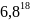
5)определяем радиоактивность (Бк/л) протактиния-231 в экстракте и рафинате из формулы:
m=
8,9·
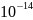 M
T1/2
A,
где
M
T1/2
A,
где
m - количество протактиния в экстракте и рафинате
M - атомная масса протатиния-231
A -удельная радиоактивность
T1/2 - период полураспада
переводим величину T1/2 в систему «CI»
один год соответствует 31 536 000 сек
32 480 лет – Х
составляем пропорцию:
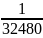 =
=
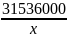
Х=
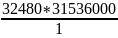 = 1,024·
= 1,024·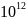 сек
сек
5а) определяем радиоактивность в экстракте.
Находим количество протактиния-231в экстракте по формуле
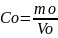 mo
=
mo
=
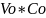 =
=
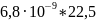 =1,53·
=1,53·
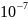 г
г
m=
8,9·
M
T1/2
A
A=
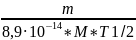 =
=
=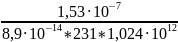 = 7,2·
= 7,2·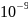 (Бк/л)
(Бк/л)
5б) определяем радиоактивность в рафинате.
Находим количество протактиния- 231 в рафинате по формуле
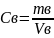 mв
=
mв
=
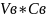 =
=
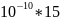 =
=
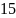 ·
·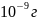
m= 8,9· M T1/2 A A= =
=
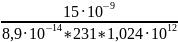 = 7,1·
(Бк/л)
= 7,1·
(Бк/л)
