
- •При температурі абсолютного нуля
- •При окисленні харчових продуктів
- •В процесі ферментативного каталізу
- •Залежить в гетерогенних системах
- •Можна визначтит за стандартних умов
- •40 КДж/моль
- •Йонна сила насиченого розчину прямує до
- •NaOh і р205
- •Підвищити температуру, підвищити тиск
- •Реакція бімолекулярна другого порядку
- •Реакція бімолекулярна першого порядку
- •Зменшує констату хімічної рівноваги
- •Різної швидкості йонів електроліту
- •Надлишку аніоців у вихідному розчині
- •Величиною водневого показника системи.
- •Величиною водневого показника системи.
- •Які не звільнюють поверхні від адсорбата
- •Які вбирають іншу речовину усім об’ємом
- •Крохмаль, мінеральні кислоти, солі
коефіцієнт активності йонів прямує до нуля
-
йонна сила насиченого розчину близька до нуля
коефіцієнт активності йонів більший одиниці
Йонна сила насиченого розчину прямує до
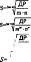
Кінетика - приклади
одиниці
Розкладання амоніаку на поверхні вольфраму за
І V
схемою: 2МН3 —7 Ы2 +ЗН2 є реакцією:
дробового порядку
першого порядку
другого порядку О. вищого порядку Е. нульового порядку
Водний розчин гідроген пероксиду з масовою часткою Н202 3 % використовують для обробки поранень. Чому в розчині Н202 розкладання відбувається повільно, а при нанесенні на рану - швидко?
фермент каталаза, що міститься у крові, каталізує розкладання Н202
пероксид швидко розкладається при контакті з вуглекислим газом повітря
фермент пероксидаза що міститься у крові, каталізує розкладання Н202
Б. пероксид швидко розкладається під дією електролітів крові Е. пероксид швидко розкладається при контакті з повітрям
Обчисліть період піврозпаду радіонукліду Радону- 220 С220^), якщо константа швидкості реакції дорівнює 1,26- 10'2с'\
тестових завдань
С. зросте у 3 рази Б. зросте в 16 разів Е. зросте в 2 рази
З лікарських засобів, які широко використовують у медичній практиці, до групи ферментних препаратів належить:
А. ериіроміцин кофеїн фестал седалгін баралгін
У скільки разів зростає швидкість більшості реакцій при підвищенні температури на кожні 10 градусів?
А. у 2-4 рази у 3 рази у 4 рази у 2-3 рази у 2 рази
Миттєву швидкість хімічної реакції визначають за рівнянням:
А. и=кс
86.
B.
Б. Е.
87.
B.
C.
О.
Е.
88.
В.
с.
в.
Е.
и=-
г2-т, о^а Ас Дг Де Дг
70с
0,5с
5с
25с
55с
А.
&
С.
Б.
Е.
и=—
и=-
За якою формулою вираховують розчинність (8) малорозчинного електроліту типу АщВп, який дисоціює за схемою АтВп ^ тЛп+ + пВш~?
А.
82.
Стан системи, який не змінюється в часі при незмінних зовнішніх факторах, називається:
рівноважним
ізотермічним
стаціонарним Б. нерівноважним Е. ізобарним
Зазначте основну одиницю вимірювання молекулярної активності ферментів:
А. мольДм‘1-с'1
В.
іт+п
§=<пі+в)|_
B.
Б.
Е.
хв
' Др~
/т+п Е. 5=>/ДР
У скільки разів збільшиться швидкість хімічної реакції при підвищенні температури від 25 до 75 'С, якщо у = 2?
А. у 24 рази у 50 разів у 32 рази у 25 разів у 64 рази
Для якої системи при збільшенні тиску рівновага зміститься в сторону прямої реакції?
2їЧО{г) + 02(г) = 2Ш2(г)
Нз(г) + і2(г)^2НІ(Г)
СОС12(г) » СО(г) + С12(г)
>Ш4С1(т) є НС1(г) + Ш3(г)
СОгОг) + Н2(г) ї± СО(г) + Н20(г)
Як зміниться швидкість прямої реакції
2КЮ + 02 = 2Ж)2, якщо концентрації вихідних речовин збільшити в два рази?
зросте в 4 рази
зросте у 8 разів
В.
ммоль-л
мольл'1
хв
Укажіть правильний математичний вираз закону дії мас для реакції + ЗН2(Г) = 2ЫНЭД
А. в = 2[Ы2]3[Н2]
Э = *1М2][Н2]3 Й = *[М2]+[Н2]3 9 = Л[Шз]2 9 = [N2 ] [Н2]3
Яке рівняння є математичним виразом ДР малорозчинного магній гідроксилу?
а. др= [м^Ч^оні
ДР=2$Л^2[01Г]
да-
ДР= [М^НОЬГ]2 ДР= [м^ноьг]
Метод прискореного старіння ліків, який використовують для визначення їх терміну придатності, грунтується на застосуванні:
Законах Рауля
правила Ванг-Гоффа
рівняння Арреніуса Б. закону дії мас
B.
Б. Е.
B.
Б. Е.
A.
B.
Б. Е.
B.
C.
а
Е.
Кінетика
Е. закону розподілу Больцмана В яких одиницях вимірюють швидкість хімічної реакції в гомогенних системах?
приклади тестових завдань
20
22 Б. 24 Е. 16
102. Який вираз справедливий для розрахунку
розчинності ферум(ІІІ) гідроксиду (в моль/л)? А- 8=^/4ДР
в.
с.
в.

Для визначення енергії активації хімічної реакції треба знати:
порядок і молекуляр-ність реакції
тепловий ефект реакції
порядок реакції
В. константи швидкості за двох температур Е. зміну енергії Гіббса
Яка умова утворення осаду важкорозчинного електроліту?
ІД<ДР
ІД>ДР
- В.
Е.
96.
9 = к[С02у
а = [со]2-[о2]
а = [С0][02]
= ^02]2[02] Э=*[2СО] -[02]
в.
Б.
Е.
98.
B.
Б. Е.
A.
B.
В.
Е.
а
с.
Б.
Е.
100.
в.
с.
в.
Е.
94.
A.
B.
C.
В.
Е. моль-м^хвГ1
Обчисліть значення константи швидкості реакції типу А + В = АВ, якщо при концентраціях речовин А і В, що відповідно дорівнюють 0,5 і 0,1 моль/л швидкість реакції становила 5 -10‘3 моль/(лхв).
Аг = 100
к = 0,1
*=100
В. к = 1-Ю’2 Е. к = 0,05
Яке рівняння є математичним виразом закону дії мас для реакції окиснення карбон(ІІ) оксиду?
МОЛЬ-Л -ХВ.
A.
B.
C.
В. 9 = [БОг] [02]2 Е.9=*{802] + [02]
Б.
Е. 9 = МС0]2-[02]
97. Що таке добуток розчинності?
А. добуток молярних концентрацій йонів у насиченому розчині малорозчинного електроліту в степенях, що дорівнюють Стехіометричним коефіцієнтам відношення концентрацій йонів у розчині до концентрації недисоційованих молекул добуток концентрацій йонів важкорозчинного електроліту
співвідношення концентрацій йонів важкорозчинного електроліту добуток активностей йіонів будь-якого . електроліту
У скільки разів збільшиться швидкість реакції при підвищенні температури на 40*С, якщо при підвищенні температури на 10"С її швидкість зростає у три рази?
А. у 18 разів ч
у 9 раз у 81 раз у 27 раз у 3 рази
99. За участю яких активних частинок відбуваються ланцюгові реакції?
А. тільки вільних радикалів йонних агрегатів радикалів і атомів активних молекул катіонів і аніонів Якщо в системі, де відбувається реакція 2Реоо + ЗСІад = 2РеС1зо[), тиск зменшиш в 3 рази, то швидкість реакції:
А. не зміниться
збільшиться в 9 разів збільшиться в 27 разів зменшиться в 27 разів зменшиться в 9 разів
Обчисліть КріВн реакції 2Ж) + 02 ^ 2Т\Ю2, якщо рівноважні концентрації дорівнюють: [Ж)2] =
8 моль/дм3, [N0] = 0,4 моль/дм3, [02] = 0,2 моль/дм3.
А. 18
с. э
ІД* ДР ІД = ДР
Середня швидкість хімічної реакції характеризує: .
концентрацію продуктів реакції в даний момент часу
зміну концентрації усіх речовин за певний проміжок часу
зміну концентрації продуктів реакції від початку до кінця реакції
В. концентрацію вихідних речовин в даний момент часу
Е. зміну концентрації реагуючих речовин за одиницючасу
Яка реакція відбулася з найбільшою швидкістю, якщо за однаковий проміжок часу утворилось по
г продуктів?
У Над + У Рад = НР(Г)
Уі Над + У. С12(г) = НС1(Г) швидкість була однаковою І/гНад+КЬи-Нвд Уг Над + У Вгад = НВг(Г)
Що таке енергія активації хімічної реакції?
різниця між тепловмістом системи і енергією активованого комплексу
різниця між внутрішньою енергією і енергією активованого комплексу
різниця між енергією активованого комплексу і теплоємністю системи
В. різниця між енергією активованого
комплексу і середньою енергією молекул реагуючих речовин
Е. різниця між кінетичною енергією молекул і потенціальною енергією
Вкажіть пару сполук, які можуть бути в розчині одночасно:
А. АдИОз і НС1
Na+, SO4
NH4+, сг
„2+
В.
с.
A.
B.
C.
D.
E.
Для розрахунку розчинності аргентум сульфіду (в моль/л) використовується рівняння:
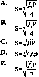
а
с.
D.
E.
Кінетика - приклади
