
Загальна характеристика елементів підгрупи оксигену.
Сірководень та сірководнева кислота та їх властивості.
1.Загальна характеристика елементів підгрупи оксигену.
До шостої групи входять елементи головної і побічної підгруп. До головної підгрупи належать: Оксиген О, Сульфур S, Селен Sе, Телур Те і радіоактивний елемент Полоній Ро, до побічної—Хром Сr, Молібден Мо і Вольфрам W. Елементи головної та побічної підгруп подібні за властивостями їхніх сполук з найвищими ступенями окиснення й істотно відрізняються за властивостями сполук з нижчими ступенями окиснення та простих речовин.
Атоми елементів головної підгрупи у зовнішньому електронному шарі містять s2p4 -електрони. Атом Оксигену відрізняється від атомів інших елементів цієї підгрупи відсутністю d-підрівня на останньому енергетичному рівні, тому він, як правило, може виявляти ковалентність, що дорівнює двом, за винятком таких сполук, як О3, СО тощо. На відміну від Оксигену, Сульфур, Селен, Телур, Полоній можуть виявляти ковалентність не тільки два, а й чотири і шість. Це пояснюється тим, що число неспарених електронів в атомах цих елементів може збільшуватись за рахунок розпаровування s- і р-електронів з переходом їх на d-орбіталі зовнішнього електронного шару.
Оскільки атом Оксигену містить тільки два неспарені електрони, він може лише двояко сполучатись у молекули: О — О і О — О — О й утворювати тільки дві алотропні видозміни: кисень та озон. Сульфур, Селен і Телур утворюють по декілька простих речовин, тому що їх атоми під час збудження можуть містити по шість неспарених електронів і число варіантів зв'язку між однаковими атомами в них значно більше, ніж у атома Оксигену. Так, для Сульфуру відомі октаедрична, моноклінна і пластична модифікації. Останнім часом добуто зелену, червону й оранжеву сірку. Аналогічні властивості виявляють Селен, Телур і Полоній, утворюючи по декілька алотропних видозмін.
У табл. 1 наведено деякі властивості Оксигену та його аналогів. У разі переходу від Оксигену до Полонію радіуси їхніх атомів збільшуються, а енергія йонізації та відносна електронегативність — зменшуються. Тому найближче до металів слід розміщувати Полоній. Всі інші елементи цієї групи — неметали. Активність їх як неметалів від Оксигену до Телуру послаблюється. Одночасно від Сульфуру до Полонію послаблюється здатність виявляти негативний ступінь окиснення, який у сполуках з металами і Гідрогеном, як правило, дорівнює -2.
Таблиця 1. Деякі властивості елементів та простих речовин головної підгрупи VI групи
Назва елемента |
Хімічний символ |
Будова зовнішньою електронного шару атома |
Радіус атома, нм |
Радіус йона Е2-, нм |
Енергія йоніїації ЕЕ+ еВ |
Відносна електронегативність |
Температура плавлення, °С |
Оксиген |
O |
2s22p4 |
0,066 |
0,136 |
13,62 |
3.50 |
-218,8 |
Сульфур |
S |
3s23p43d0 |
0,104 |
0,182 |
10,36 |
2,6 |
119,3 (ромб.) |
Селен |
Se |
4s24p44d0 |
0,117 |
0,193 |
9,75 |
2,5 |
217(гекс.) |
Телур |
Te |
5s25p45d0 |
0.137 |
0,211 |
9,01 |
2,1 |
449.8 |
Полоній |
Po |
6s26p46d0 |
0,137 |
- |
8,43 |
- |
- 254 |
Оксиген та кисень. Загальна характеристика і методи добування кисню.
Оксиген — найпоширеніший елемент у земній корі, його вміст становить 47 мас. %, або 55 ат. %. Кисень — проста речовина, утворена Оксигеном, міститься в атмосферному повітрі, у зв'язаному стані Оксиген входить до складу води, кварцу, силікатів, алюмосилікатів, сполук тваринного і рослинного походження.
Вперше кисень у чистому вигляді добув шведський хімік К. В. Шеєле (1772р.), а в 1774 р. англійський хімік Д. Прістлі добув його з оксиду меркурію(II). До складу природного Оксигену входять три стабільні нукліди 16О (99,76 %), 17О (0,04 %) і 18О (0,2 %).
У вільному стані кисень О2 міститься у повітрі. Крім О2 у верхніх шарах атмосфери є проста речовина Оксигену озон О3, максимальна концентрація якого зафіксована на висоті близько 25 км від поверхні Землі. Цей озоновий шар утворився з О2 під дією ультрафіолетового проміння. Він має дуже важливе значення, оскільки затримує жорстке (короткохвильове) сонячне проміння, тривала дія якого смертельно небезпечна для всіх живих організмів.
Кисень можна добути з повітря або розкладанням сполук Оксигену. Атмосферне повітря — це суміш багатьох газів. Основну масу повітря становлять кисень (20,9 об. %, або 23,2 мас. %) та азот (78,2 об. %, або 75,5 мас. %). До складу повітря входять також невеликі кількості інертних газів (0,9 об. %, або 1,3 мас. %), оксид карбону(ІV) та водяна пара. Майже завжди у повітрі є пил та інші випадкові домішки. Сталими компонентами повітря вважають кисень, азот та інертні гази, вміст яких у повітрі практично всюди однаковий. До змінних компонентів повітря належать оксид карбону(ІV), водяна пара, пил, вміст яких змінюється залежно від природних умов і температури.
У повітрі можуть перебувати і випадкові домішки, наприклад, оксид сульфуру(ІV) SO2, який утворюється в процесі випалювання сірчистих руд, спалювання вугілля тощо; оксиди нітрогену, що виникають в атмосфері під дією електричних розрядів, тощо.
У промислових масштабах кисень добувають багатоступінчастою дистиляцією зрідженого повітря. Оскільки температура кипіння кисню (-183 °С) вища, ніж температура кипіння азоту (-195,8 °С), атмосферний кисень легше зріджується і тому зріджене повітря містить більше кисню, ніж атмосферне. Під час зберігання зріджене повітря внаслідок випаровування азоту ще більше збагачується на кисень. Із зрідженого повітря добувають не тільки кисень, а й азот та інертні гази, що містяться в ньому. Під час перегонки повітря спочатку відділяється азот, а кисень залишається у рідкому стані.
Іноді в промисловості, коли потрібно добути водень високого ступеня чистоти, використовують електроліз води, однак у цьому разі попутно утворюється і кисень. Електролітом у цьому процесі є 30%-й розчин КОН, катодом — залізо, анодом — нікель; електроди розділені азбестовою перетинкою. На електродах відбуваються такі процеси:
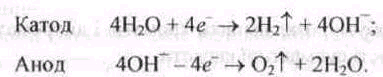
Кисень дуже високого ступеня чистоти добувають за реакціями
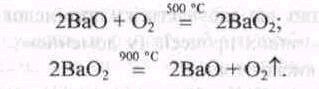
Кисень можна добути також розкладанням білильного вапна за наявності солей Кобальту або Купруму:
![]()
У лабораторіях використовують кисень промислового виробництва, що міститься у стальних балонах. Невеликі кількості кисню зручно добувати розкладанням пероксиду гідрогену Н2О2, використовуючи як каталізатор платинову фольгу, вкриту платиновою черню. Невеликі кількості зрідженого кисню (як і зрідженого повітря) зберігають у посудинах Дьюара.
У лабораторних умовах кисень добувають з різних оксигеновмісних сполук— оксидів, пероксидів, солей їх термічним розкладанням:
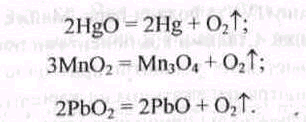
Ці реакції легше відбуваються за наявності кислот, які зв'язують оксиди, що утворюються, у солі. Так, легко відбувається реакція між оксидом мангану(ІV) і концентрованою сульфатною кислотою:
![]()
Кисень можна добути також і з пероксидів дією на них води або оксиду карбону(ІV):
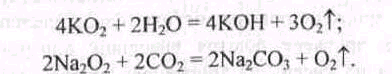
Найчастіше у лабораторній практиці для добування кисню використовують реакції розкладання таких оксигеновмісних солей, як перманганат та хлорат калію:
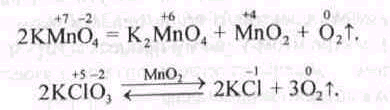
Кисень можна добути розкладанням хроматів і дихроматів; реакцію краще проводити за наявності сульфатної кислоти:
![]()
Понад половини кисню, що добувається у промисловості, використовується для інтенсифікації хімічних процесів (у доменному процесі, виробництві сульфатної та нітратної кислот тощо).
Кисень застосовують для досягнення високих температур (до 3200 °С) спалюванням у спеціальних пальниках суміші різних горючих газів (ацетилен, водень) з киснем. Таке полум'я застосовують для плавлення кварцу та інших тугоплавких речовин. Рідкий кисень використовують як високоефективний окисник палива у ракетних двигунах. Застосовують кисень також і в медицині (кисневі подушки, палати).
Властивості кисню та сполук оксигену.
Кисень — це безбарвний газ без запаху, трохи важчий за повітря: маса 1 л кисню за нормальних умов дорівнює 1,43 г, а маса 1 л повітря — 1,293 г. Розчинність кисню у воді невелика: в 100 об'ємах води за температури О°С розчиняється 4,9 об'єму кисню, а за температури 20°С — 3 об'єми.
Зріджений кисень, що є блакитною рідиною, кипить за температури -118 °С, в разі охолодження нижче -200 °С кисень замерзає. Твердий кисень має температуру плавлення -219 °С. Критична температура кисню, тобто температура, вище якої він не зріджується, становить -118 °С. Критичний тиск кисню дорівнює 5035,85 кПа.
Оксиген утворює двохатомні молекули, що характеризуються високою міцністю: стандартна ентальпія атомізації кисню становить 498 кДж/моль. Дисоціація кисню на атоми стає помітною лише за температури 1500— 2000 °С. Енергетична схема утворення молекули O2 подана на рис.
Внаслідок кратності зв'язку міжатомна відстань у молекулі О2 (0,121 нм) менша, ніж довжина зв'язку О—О (0,148 нм). Тому молекула О2 досить стійка.
Як і для інших p-елементів 2-го періоду, максимальна ковалентність Оксигену дорівнює чотирьом. При цьому атоми Оксигену можуть перебувати у стані sр3-, sр2- та sр-гібридизації, що відповідає тетраедричному, трикутному та лінійному розміщенню -зв'язків. Два останніх гібридизованих стани атома Оксигену стабілізуються за рахунок утворення відповідно одного і двох -зв'язків. Прикладами сполук, в яких виявляються sр3-, sр2- та sp-гібридизовані стани атома Оксигену, відповідно можуть бути кристалічні ВеО, ТIO2 і SіО2. Кратність зв'язку Si – O – Si та Ті – О – Ті перевищує одиницю за рахунок -зв'язування.
Наявністю в атома Оксигену двох неподілених пар електронів зумовлена можливість донорно-акцепторної взаємодії й утворення оксоніевих сполук, в яких атоми Оксигену сполучені трьома ковалентними зв'язками. Так, у кислих водних розчинах містяться йони гідроксонію [Н3О] і навіть [H9О4].
Кисень розчиняється у деяких розплавлених металах (срібло, платина, золото, паладій). Наприклад, в одному об'ємі срібла розчиняється близько 10 об'ємів кисню. Кисень має високу хімічну активність. За реакційною здатністю він поступається тільки галогенам. Взаємодія речовин з киснем у багатьох випадках має характер горіння.
Кисень сприяє перебігу процесів життєдіяльності, що забезпечують живі організми енергією. За нестачі кисню послаблюється життєдіяльність організму і може наступити смерть. Надлишок кисню призводить до того, що процеси життєдіяльності відбуваються надзвичайно енергійно, й організм швидко зношується. Під час вдихання кисню живими організмами проходить хімічна реакція між карбоновмісними сполуками і киснем із виділенням вуглекислого газу.
З більшістю простих речовин кисень взаємодіє безпосередньо, утворюючи оксиди. Лише відносно фтору кисень виявляє відновні властивості. За звичайних умов з киснем безпосередньо не взаємодіють інертні гази, деякі благородні метали (золото, іридій), галогени, азот.
Більшість металів та неметалів енергійно сполучається з киснем:
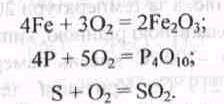
Реакції окиснення відбуваються з різною швидкістю. Повільне окиснення органічних речовин називається гниттям.
Окиснення, що відбувається з інтенсивним виділенням теплової та світлової енергії, називається горінням. Щоб речовина зайнялась, її потрібно нагріти до температури спалаху і забезпечити умови для підтримування горіння. Кисень — найпоширеніша з речовин, що підтримує горіння.
Для атома Оксигену, що входить до складу більшості сполук, характерні ступені окиснення -2 і -1: оксигеновмісних сполук з іншими ступенями окиснення Оксигену мало і вони не знайшли широкого застосування.
Найпоширенішою і найважливішою сполукою Оксигену із ступенем окиснення -2 є вода Н2О.
Воду можна як відновити (з утворенням Н2), так і окиснити (з утворенням О2). Відновлення Н2О до водню відбувається під дією активних металів, окиснення до кисню — під дією фтору, деяких багатозарядних катіонів, наприклад Со3+ а також деяких складних аніонів, утворених елементами з вищими ступенями окиснення. Наприклад, воду здатний окиснити перманганат-іон МnО4-:
![]()
Тому розчин КМnO4 повільно розкладається з утворенням МnО2 та O2. Електронодонорні властивості води виявляються в оксонієвих сполуках, аквакомплексах і кристалогідратах. Вода, що входить до складу кристалогідратів солей, здебільшого координується навколо катіонів. Найхарактерніше координаційне число для води дорівнює 6; у цьому разі молекули Н2О утворюють навколо катіона (Nа+, Mg2+, Аl3+, Сr3+ тощо) октаедр.
Важливими сполуками Оксигену, де він виявляє ступінь окиснення -2, є оксиди. Характер оксидів за періодами і групами періодичної системи елементів Д. І. Менделєєва закономірно змінюється. В періодах, згідно з природою електропозитивного елемента, відбувається поступовий перехід від оснбвних через амфотерні оксиди до кислотних. Так, для елементів 3-го періоду цей перехід схематично можна подати так:
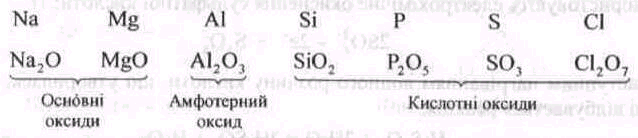
Відмінність властивостей оксидів різного типу виявляється під час їх взаємодії з водою, а також під час взаємодії оксидів різного типу між собою.
Сульфур. Добування і властивості сірки.
Атом Сульфуру, як і Оксигену, в зовнішньому електронному шарі містить шість електронів, два з яких є неспареними (1s2 2s2 2p6 3s2 3p4 3d0). Проте на відміну від атома Оксигену в атомі Сульфуру валентними можуть бути не лише 3s- і Зр-, а й 3d-орбіталі. Тому в разі збудження атомів Сульфуру вони можуть містити до шести неспарених електронів. Отже, ці два типові елементи VI групи, крім спільних властивостей, повинні істотно відрізнятися один від одного. Як і в інших p-елементів 3-го періоду, максимальна ковалентність Сульфуру дорівнює шести, найстійкішими є sp3-гібридизований стан, а також sp3d2-стан.
Для Сульфуру характерні такі ступені окиснення: -2 (сульфідна кислота, сульфіди); +4 (оксид сульфуру(ІУ), сульфіти); +6 (сульфатна і дисульфатна кислоти, сульфати).
Вміст Сульфуру у земній корі становить 5*10-2 мас. %; в океанах його міститься 9*10-20 %. Сульфур у природі трапляється у вільному стані (самородна сірка). До найважливіших природних сполук Сульфуру належать сульфати: мірабіліт, або глауберова сіль, Nа2SO4•10Н2О; гіпс—СаSО4•2Н2О;
сульфіди і полісульфіди — цинкова обманка ZnS, мідний блиск Сu2S, кіновар НgS, свинцевий блиск, або галеніт, РbS, залізний колчедан, або пірит, FеS2 тощо. Великі кількості сульфатів перебувають у розчиненому стані в природних водах. Сульфур входить до складу білкових речовин. Виявлено Сульфур також в метеоритах у вигляді сульфіду форуму.
Найлегше добувати просту речовину Сульфуру — сірку з підземних покладів шахтним способом або виплавляти її з породи під дією гарячої водяної пари. Поклади самородної сірки є в Туркменистані, Узбекистані, Україні, Росії, у Мексиці, США, Японії, Італії.
Сірку добувають також із газів, що містять Н2S і SO2 (природний, коксовий гази, гази, що утворюються під час випалювання сульфідних руд, тощо).
Важливим джерелом добування сірки є залізний колчедан, або пірит, FеS2. Під час нагрівання піриту без доступу повітря відбувається реакція розкладу:
![]()
Очищають сірку перегонкою. У вигляді порошку сірку можна добути швидким охолодженням її пари. Порошкоподібну сірку називають сірчаним цвітом. Сірку високого ступеня чистоти добувають перекристалізацією із сірковуглецю.
Як уже зазначалося, Сульфур існує у вигляді кількох алотропних видозмін. За кімнатної температури стійкою є жовта ромбічна сірка (-сірка), що плавиться за температури 112,8 °С. має густину 2,07 г/см3, у воді не розчиняється, розчиняється у бензолі і деяких інших розчинниках.
В інтервалі температур 95,4—119,3 °С (температура плавлення сірки) стійкою є моноклінна сірка (-сірка). Кристали р-сірки швидко ростуть переважно в одному напрямку і тому мають голчасту форму.
Алотропні видозміни - і -сірки складаються з молекул S8, які мають форму кілець. У кристалах -сірки кільця розміщуються на відстані 0,330 нм одне від одного і сполучаються між собою за допомогою сил Ван дер Ваальса Відмінність у властивостях кристалічних модифікацій сірки зумовлена різною структурою кристалів, а не різним числом атомів у молекулах (як у молекулах кисню й озону).
Відомі також і інші модифікації сірки. Так, у разі швидкої конденсації пари сірки на поверхні, що охолоджується рідким азотом, конденсується пурпурна сірка Підвищення тиску викликає алотропні перетворення сірки. Під час повільного нагрівання рідкої сірки до 1500 °С її молекулярний склад змінюється від S8 до S2. Молекули S2 парамагнітні і побудовані аналогічно О2. В усіх інших станах молекули сірки діамагнітні.
Сірка є типовим активним неметалом. Вона здатна сполучатися з лужними металами за кімнатної температури, а з іншими —у разі нагрівання. Такі метали як мідь срібло, свинець, бісмут, кадмій, ртуть тощо, мають підвищену спорідненість до сірки, тому всі вони трапляються у природі переважно у вигляді сульфідних мінералів. Срібні речі, що зберігаються тривалий час, тьмяніють внаслідок взаємодії з сірководнем, який завжди є у повітрі, а мідна
фольга здатна займатися у парі сірки.
У разі сполучення різних металів з сіркою утворюються сульфіди:
![]()
Сірка за кімнатної температури активно взаємодіє з фтором. У разі слабкого нагрівання сірка здатна окиснювати багато простих і складних речовин, і водночас вона сама досить легко окиснюється киснем і галогенами.
Сірка значно відрізняється від кисню. Вона може бути як окисником
![]()
так і відновником
![]()
а також брати участь у реакціях диспропорціонування:
![]()
Вільна сірка слабкіший окисник, ніж кисень, оскільки вона окиснюється киснем Проте швидкість взаємодії багатьох речовин із сіркою здебільшого значно вища ніж із киснем. Наприклад, свинець, мідь і залізо та деякі інші метали киснем окиснюються повільно, а з сіркою під час нагрівання реагують миттєво. Однією з причин високої активності сірки є менша міцність молекул S8 порівняно з О2.
Сірку широко використовують у народному господарстві: у виробництві сульфатної кислоти, як вулканізатор каучуку, для знищення деяких шкідників сільського господарства (сірчаний цвіт), виробництва сірників, сірководню, ультрамарину тощо.
![]()
