
- •«Строение атома» история представлений о строении атома
- •Модели строения атома
- •Двойственная природа света и материи
- •Понятие о квантовой механике
- •Квантовомеханическая модель атома
- •Количество и типы орбиталей, разрешенных для отдельных электронных подоболочек
- •Распределение электронов в многоэлектронных атомах
- •Способы записи электронных конфигураций атомов и ионов
- •Главная причина периодичности свойств химических элементов
- •Периодические свойства атомов и ионов элементов
«Строение атома» история представлений о строении атома
Впервые понятие «атом» (неделимый) было введено греческим философом Демокритом в V веке до нашей эры.

В начале века английский химик и физик Джон Дальтон

вновь предположил, что вещества состоят из мельчайших частиц - атомов. Он установил, что атомы одного и того же химического элемента имеют одинаковые свойства, а разным элементам соответствуют разные атомы. Введена важнейшая характеристика атома - атомная масса. Атом также считался неделимой частицей.
Однако в конце и начале веков появились экспериментальные доказательства сложной структуры атома: фотоэффект

(явление, когда при освещении некоторых металлов с их поверхности испускаются носители электрического заряда), катодные лучи (поток отрицательно заряженных частиц - электронов из катода в вакуумированной трубке, содержащей катод и анод),
рентгеновские лучи (электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей),
радиоактивность (явление самопроизвольного превращения одного химического элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения).
Таким образом, было установлено, что атомы состоят из отрицательно и положительно заряженных частиц, сильно взаимодействующих между собой.
Модели строения атома
Одна из первых моделей строения атома была предложена английским ученым Томсоном в 1903 г.

Атом представлялся как «море положительного электричества» с вкрапленными в него электронами. Суммарный отрицательный заряд электронов равен суммарному положительному заряду атома.

Другой английский физик Э. Резерфорд

изучал прохождение - частиц через металлическую фольгу, за которой располагался детектор -частиц (экран из сульфида цинка). - частицы являются двукратно ионизированными атомами гелия (Не2+).
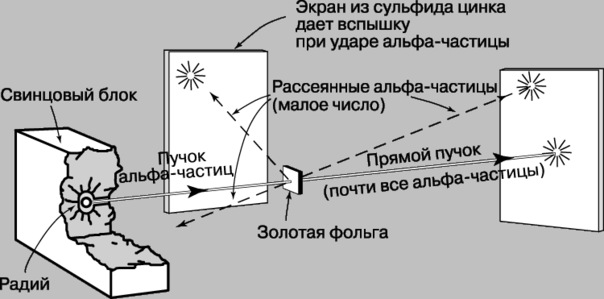
Опыт Резерфорда указывает на «ажурную» структуру металлической фольги, такую, что большая часть металла не создает препятствий для прохождения довольно тяжелых частиц. Таким образом, модель атома по Томсону противоречила эксперименту.
Резерфорд предложил «планетарную» модель атома, уподоблявшую атом солнечной системе.
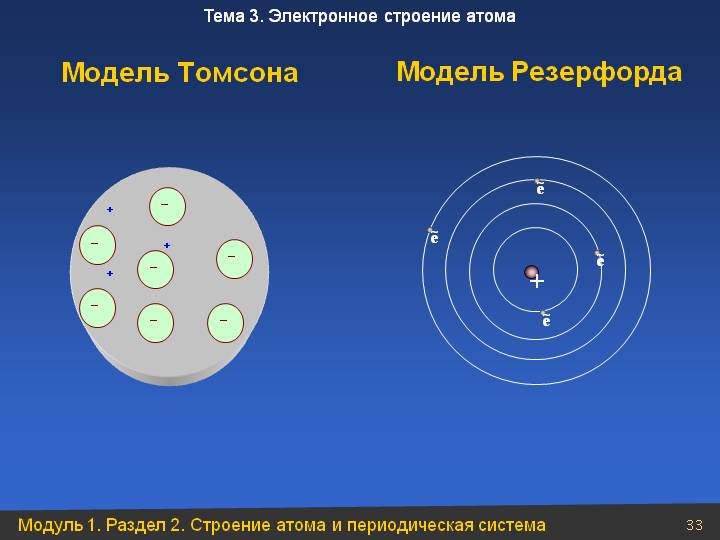
Согласно планетарной модели в центре атома находится очень маленькое положительно заряженное ядро, размеры которого в 100 000 раз меньше размеров самого атома. Это ядро заключает в себе почти всю массу атома и несет положительный заряд. Вокруг ядра движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома.
К моменту создания планетарной модели атома были получены экспериментальные сведения о структуре атома.

Украинские ученые сфотографировали атом
Впервые сфотографировали вращение атомов
Было установлено, что свет, испускаемый атомами газов, имеет линейчатый спектр, в котором спектральные линии могут быть объединены в серии (рис.1).
Рис.
1 Линейчатый спектр атома водорода в
видимой области спектра (серия Бальмера).
(
- частота,
- длина волны)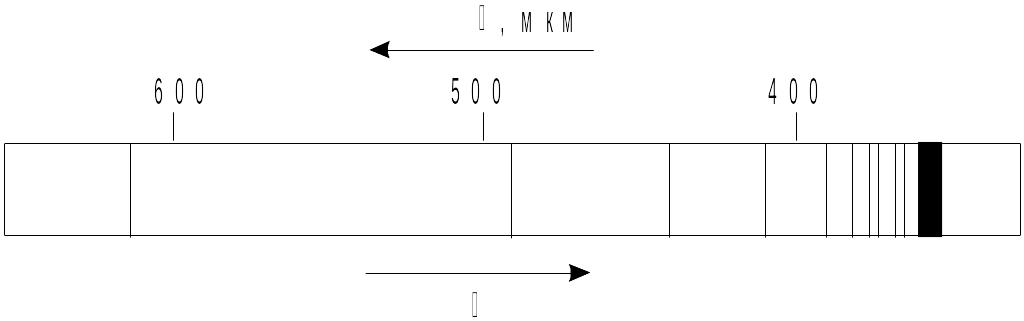
![]() (2.1)
(2.1)
где n1 и n2 - целые числа;
R - постоянная Ридберга.
В 1900 году немецкий физик М. Планк выдвинул гипотезу о квантовании энергии в природе, которая полностью подтвердилась.

Согласно Планку энергия изменяется скачкообразно - квантуется. Наименьшая порция (квант) энергии определяется выражением Планка:
E = h.
где h - постоянная Планка, h = 6,625.10-34 Дж.с,
- частота.
Планетарная модель строения атома оказалась неспособной объяснить линейчатый спектр испускания атомов водорода и тем более объединение линий спектра в серии. Согласно данной модели частота излучения атома должна равняться механической частоте колебаний или быть кратной ей:
= n.0 ,
что не согласуется с формулой Бальмера. Кроме того, притяжение между электроном и ядром в конечном итоге должно привести к «падению» электрона на ядро, а это ведет к исчезновению атома. Однако, большинство атомов существует сколь угодно долго.
Выход из создавшегося положения был предложен датским физиком Н. Бором в 1913 г. (теория атома по Бору).

Он доказал:
В атоме, который не подвержен сильным внешним воздействиям, электрон движется не излучая энергии.
Энергия электронов в атоме не может быть любой, она принимает строго определенные значения. Электрон при этом может находиться на строго определенных энергетических уровнях.
Атом излучает или поглощает энергию при переходе электрона с одного энергетического уровня на другой.

Теория Бора успешно объяснила появление линейчатого спектра и наличие серий в спектре испускания атомов водорода. Однако она имела и серьезные недостатки:
Количественные расчеты многоэлектронных атомов оказались чрезвычайно сложными и практически не осуществимыми.
Постулаты Бора были остроумной догадкой о строении атома водорода, но они не имели физического обоснования.
Теория не объясняла тонкую структуру спектров атомов, заключающуюся в том, что отдельные линии расщепляются на несколько других. Она ошибочно описывала магнитные свойства атома водорода, принципиально не могла правильно описать образование химической связи в молекулах.
